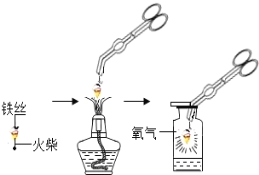
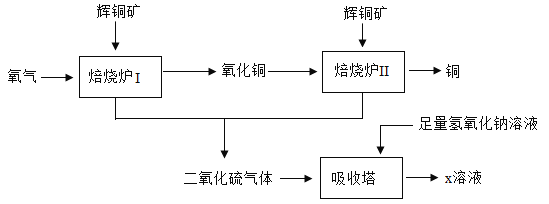
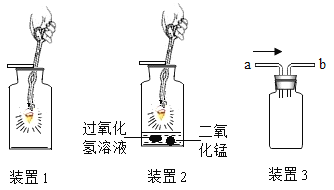
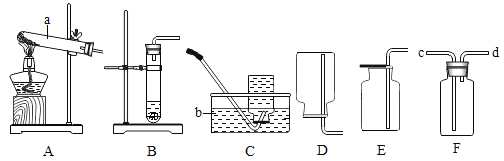
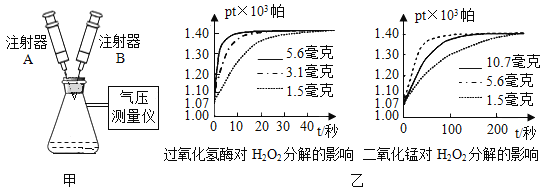
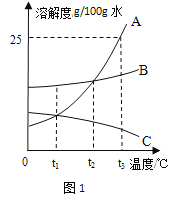
题目内容
【题目】如图为元素周期表第四周期的局部。下列有关说法正确的是( )

A. 砷和硒均属于金属元素
B. 锗元素的相对原子质量x小于69.72
C. 镓原子的核电荷数为31
D. Se2+的核外电子数为34
【答案】C
【解析】
根据元素周期表中单元格的意义分析,每一小方格中左上角数字表示原子序数,符号表示元素符号,下方数字表示相对原子质量。
A、四个小方格中表示的元素名称分别是镓、锗、砷、硒,砷、硒属于非金属元素,故错误;
B、根据元素周期表的一般规律可知锗元素的相对原子质量X大于69.72,故错误;
C、镓元素的原子序数为31,原子序数=核电荷数=31,故,正确;
D、砷原子的原子序数为34,原子序数=核外电子数=34,Se2+的核外电子数为32,故错误; 故选:C。

练习册系列答案
相关题目
【题目】在宏观、微观、符号之间建立联系是化学学习的基本方法。
(1)按照要求填写下表:
名称 | 氦气 | _____ | 亚硝酸钠 |
符号 | _____ |
| _____ |
(2)将塑料袋密封良好的方便面从平原带到高原时塑料袋鼓起。试从微观的角度分析原因是_____;
(3)构成物质的微观粒子有三种:分子、原子、离子。现有Na、NaCl、![]() 、Fe、
、Fe、![]() 、
、![]() 六种物质,由分子构成的物质有_____。
六种物质,由分子构成的物质有_____。