题目内容
双氧水(H2O2)既是工业上重要的绿色氧化剂,又是常用的医用消毒剂,还用于实验室制取氧气.
(1)小明配制了5%的双氧水600g,则600g溶液中溶质为
(2)小明倒出了300g双氧水溶液进行消毒,则剩下的溶液中溶质的质量分数为
(3)双氧水是由氢元素和氧元素组成的,氢元素和氧元素的本质区别是
A电子层数不同 B最外层电子数不同 C质子数不同 D中子数不同
(4)请写出实验室用双氧水制取氧气的化学方程式
(1)小明配制了5%的双氧水600g,则600g溶液中溶质为
30
30
克.(2)小明倒出了300g双氧水溶液进行消毒,则剩下的溶液中溶质的质量分数为
5%
5%
.(3)双氧水是由氢元素和氧元素组成的,氢元素和氧元素的本质区别是
C
C
.A电子层数不同 B最外层电子数不同 C质子数不同 D中子数不同
(4)请写出实验室用双氧水制取氧气的化学方程式
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
分析:(1)根据溶质的质量=溶液的质量×溶质的质量分数解答;
(2)溶液具有均一性、稳定性;
(3)根据元素的概念分析解答;
(4)根据双氧水反应原理及方程式的书写方法书写方程式.
(2)溶液具有均一性、稳定性;
(3)根据元素的概念分析解答;
(4)根据双氧水反应原理及方程式的书写方法书写方程式.
解答:解:(1)600g溶液中溶质为:600g×5%=30g;
故答案为:30;
(2)溶液具有均一性,所以剩下的溶液中溶质的质量分数和原溶液的溶质质量分数相同,为5%;
故答案为:5%;
(3)元素是具有相同核电荷数(即核内质子数)的一类原子的总称,所以不同种元素的本质区别在于质子数不同;
故选 C;
(4)双氧水在二氧化锰的催化作用下分解生成水和氧气;
故答案为:2H2O2
2H2O+O2↑.
故答案为:30;
(2)溶液具有均一性,所以剩下的溶液中溶质的质量分数和原溶液的溶质质量分数相同,为5%;
故答案为:5%;
(3)元素是具有相同核电荷数(即核内质子数)的一类原子的总称,所以不同种元素的本质区别在于质子数不同;
故选 C;
(4)双氧水在二氧化锰的催化作用下分解生成水和氧气;
故答案为:2H2O2
| ||
点评:本题考查了溶质的质量分数、溶液的特征、元素的概念、方程式的书写,掌握相关知识即可顺利解答.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
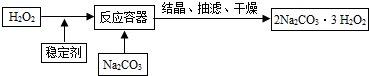
“过碳酸钠”(2Na2CO3·3H2O2)俗称固体双氧水,它既有碳酸盐的性质,又有双氧水的不稳定性和氧化性,是很好的消毒剂和供氧剂,广泛应用于洗涤、印染和医药等领域。“过碳酸钠”的制备流程如下:
 |
请回答下列问题:
⑴H2O2在催化或受热条件下易分解,其化学方程式为 ;在上述流程中,向反应前的H2O2中加入稳定剂的作用是 。
⑵在“过碳酸钠”中加入下列物质时,不会导致“过碳酸钠”变质的是 (填序号)。
A.二氧化锰 B.稀盐酸 C.硫酸钠 D.石灰水
⑶“过碳酸钠”极易分解,得到碳酸钠、水和氧气,其反应方程式可表示为
2(2Na2CO3·3H2O2)![]() 4Na2CO3+6H2O+3O2↑
4Na2CO3+6H2O+3O2↑
请通过计算说明:①若“过碳酸钠”分解产生氧气12g,则同时产生碳酸钠的质量是多少?
②若将上述产生的碳酸钠全部配制成溶质质量分数为10.6%的溶液,需加水的质量是多少?

 .石灰水
.石灰水 4Na2CO3+6H2O+3O2↑请通过计算说明:
4Na2CO3+6H2O+3O2↑请通过计算说明: