题目内容
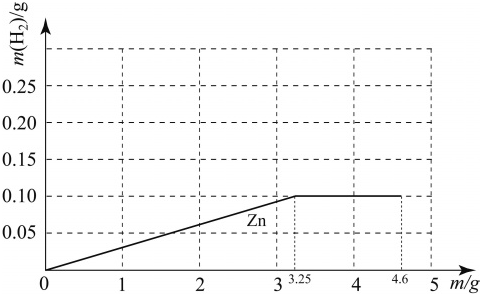
已知钠与水反应的化学方程式为:2Na+2H2O= 2NaOH+ H2↑。质量均为m g的钠、镁、锌三种金属分别与25 g质量分数为19.6% 的稀硫酸反应。由于金属的质量不确定,产生的氢气的质量大小有多种可能(不考虑镁与水的反应),如镁、锌产生氢气的质量相同且都大于钠产生的氢气质量的情况表示为Mg=Zn >Na。若m=3g时,下列表示正确的是
- A.Na>Mg=Zn
- B.Na=Mg=Zn
- C.Mg=Zn >Na
- D.Na>Mg>Zn
D
试题分析:25g质量分数为19.6% 的稀硫酸中的硫酸的质量=25g×19.6%=4.9g,根据三种金属与定量的酸反应所需的金属的质量分析酸液是否有剩余,然后结合有关的题目信息和相关的化学方程式的计算分析解答。
①设25g质量分数为19.6% 的稀硫酸与锌恰好完全反应消耗锌的质量为x,则
Zn+H2SO4=ZnSO4+H2↑
65 98
x 4.9g
65:x=98:4.9g
解得,x=3.25g>3g,
所以锌完全反应,酸有剩余;
②设25g质量分数为19.6% 的稀硫酸与镁恰好完全反应消耗镁的质量为y,则
Mg+H2SO4=MgSO4+H2↑
24 98
y 4.9g
24:y=98:4.9g
解得,y=1.2g<3g,
所以酸完全反应,金属有剩余;
③设25g质量分数为19.6% 的稀硫酸与钠恰好完全反应消耗钠的质量为z,则
2Na+H2SO4=Na2SO4 +H2↑
46 98
z 4.9g
46:z=98:4.9g
解得,z=2.3g<3g,
所以酸完全反应,金属有剩余;且剩余的钠还能够和水反应生成氢气,由于镁、锌的氢气来源于酸中的氢,而钠生成的氢气含有酸中的氢和反应的水中的部分氢,故生成氢气质量关系为:钠>镁>锌。故选D
考点:根据化学反应方程式的计算
点评:本题为根据化学方程式计算,完整的计算步骤、规范的书写格式,是解答此类问题的关键;此外,对物质反应中的反应物过量问题的分析更是重点。
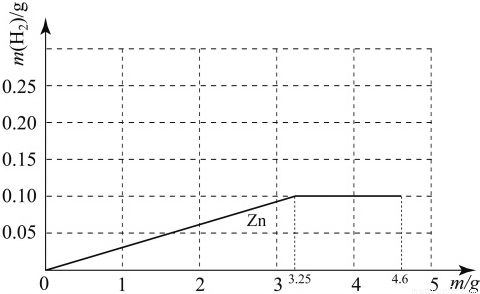
试题分析:25g质量分数为19.6% 的稀硫酸中的硫酸的质量=25g×19.6%=4.9g,根据三种金属与定量的酸反应所需的金属的质量分析酸液是否有剩余,然后结合有关的题目信息和相关的化学方程式的计算分析解答。
①设25g质量分数为19.6% 的稀硫酸与锌恰好完全反应消耗锌的质量为x,则
Zn+H2SO4=ZnSO4+H2↑
65 98
x 4.9g
65:x=98:4.9g
解得,x=3.25g>3g,
所以锌完全反应,酸有剩余;
②设25g质量分数为19.6% 的稀硫酸与镁恰好完全反应消耗镁的质量为y,则
Mg+H2SO4=MgSO4+H2↑
24 98
y 4.9g
24:y=98:4.9g
解得,y=1.2g<3g,
所以酸完全反应,金属有剩余;
③设25g质量分数为19.6% 的稀硫酸与钠恰好完全反应消耗钠的质量为z,则
2Na+H2SO4=Na2SO4 +H2↑
46 98
z 4.9g
46:z=98:4.9g
解得,z=2.3g<3g,
所以酸完全反应,金属有剩余;且剩余的钠还能够和水反应生成氢气,由于镁、锌的氢气来源于酸中的氢,而钠生成的氢气含有酸中的氢和反应的水中的部分氢,故生成氢气质量关系为:钠>镁>锌。故选D
考点:根据化学反应方程式的计算
点评:本题为根据化学方程式计算,完整的计算步骤、规范的书写格式,是解答此类问题的关键;此外,对物质反应中的反应物过量问题的分析更是重点。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目