题目内容
【题目】将10克不纯的锌粒(杂质不溶于水也不与水反应)和足量的100克稀硫酸投入到烧杯中,恰好完全反应后再次称量烧杯总质量为109.8克。(友情提示:锌粒与稀硫酸反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑)。请计算:
(1)反应生成的氢气的质量为____;
(2)计算参加反应的锌的质量________
【答案】0.2g 6.5g
【解析】
(1)锌粒和足量的稀硫酸反应生成氯化锌和氢气,锌粒中杂质不溶于水也不和水反应,生成物中只有氢气一种气体,根据质量守恒定律可知,反应前各物质的总质量等于反应后物质的总质量,反应前物质的总质量=10g+100g=110g,反应后质量仅为109.8g,反应前后质量变化即是生成的氢气质量,所以生成氢气的质量=110g-109.8g=0.2g故填0.2g;
(2)由前问可知生成氢气的质量为0.2g,根据锌和稀硫酸反应的化学方程式即可计算出参加反应的锌的质量,设参加反应的锌的质量为X,
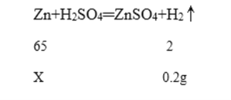
![]() =
= ![]()
解得X=6.5g,故填6.5g。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】如图是木炭还原氧化铜的探究实验装置
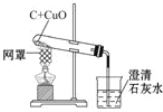
[提出问题]木炭还原氧化铜产生什么气体?
[提出猜想]产生的气体有三种情况:
①CO; ②CO2; ③________。
[设计方案]实验前后分别对试管和烧杯里
的物质进行称量,数据如下:
称量对象 | 反应前质量 | 反应后质量 | 质量差 |
试管+固体混合物 | m1 | m2 | △m1即(m1-m2) |
烧杯+澄清石灰水 | m3 | m4 | △m2即(m4-m3) |
(1)若△m2=0,说明反应产生的气体不能被澄清石灰水吸收,则猜想________成立。
(2)若猜想②正确,理论上△m1与△m2的关系是:△m1______△m2(填“>”“<”或“=”)。
[实验并记录]实验得到的数据如下表:
称量对象 | 反应前质量 | 反应后质量 | 质量差 |
试管+固体混合物 | 69.89g | 65.49g | △m1 |
烧杯+澄清石灰水 | 118.89g | 122.69g | △m2 |
用以上实验数据分析,结果应该是猜想________成立。
[反思与评价]经查阅资料知道:木炭还原氧化铜产生CO2气体,该反应的化学方程式为___。
【题目】下列各选项中的说法完全正确的是( )
A. 化学式 俗称 学名 Ca(OH)2 熟石灰 氢氧化钙 NaOH 烧碱 氢氧化钠 CaO 石灰石 氧化钙 NaCl 食盐 氯化钠 |
B.用pH试纸测定石灰水的pH,如图所示,则测得结果与实际值相比偏高 |
C..下列符号中既能表示物质的元素组成,又能表示该物质的一个分子的是③⑤ ①Cu ②N ③CO2 ④Na2CO3 ⑤CH4 | D.逻辑推理是一种重要的化学思维方法。以下推理完全正确: ①酸碱中和反应有水生成,有水生成的反应一定是酸碱中和反应 ②碱溶液能使无色酚酞试液变红,能使无色酚酞试液变红的一定是碱溶液 |
A. A B. B C. C D. D