题目内容
世界上因锈蚀每年损失钢铁约为产量的20%~40%.现要测定锈蚀的钢铁中铁单质的质量分数,请回答下列问题.
(1)配制200g14.6%的稀盐酸,需要右图标签浓盐酸的体积是mL
(2)取l 1.5g表面锈蚀的钢铁样品,用砂纸轻轻擦去表面的铁锈,进行如下实验.
①把擦去表面铁锈的钢铁样品,加入烧杯中,再加入lOOg 14.6%稀盐酸恰好完全反应后,得到滤液和滤渣,写出发生反应的化学方程式为
②上述反应生成气体的质量(x)比例式是
③原样品中单质铁的质量分数为(精确到0.1%)
④若把反应后溶液蒸发掉10.8g水,则所得溶液中溶质的质量分数是
⑤若建设地铁需要钢材4万吨,假设钢材的含碳量为O.5%,用含氧化铁80%的赤铁矿来炼制,则需要赤铁矿的质量为.

【答案】分析:(1)根据稀释前后溶液中溶质的质量不变列出等式.
(2)①此处发生的反应为铁和盐酸发生的反应.
②化学方程式中任意两种物质之间(除催化剂外)都存在固定的比例关系,已知参加反应的盐酸的质量,据此可写出求氢气质量的比例式.
③根据盐酸溶液中溶质的质量可求出单质铁的质量,再根据 %即可求出样品中单质铁的质量分数.
%即可求出样品中单质铁的质量分数.
④溶液中溶质的质量分数= %,溶质为氯化亚铁,可根据盐酸溶液中溶质的质量求出,溶液的质量=溶质的质量+溶剂的质量,溶质的质量已知,溶剂的质量=盐酸溶液中水的质量-蒸发的水的质量.
%,溶质为氯化亚铁,可根据盐酸溶液中溶质的质量求出,溶液的质量=溶质的质量+溶剂的质量,溶质的质量已知,溶剂的质量=盐酸溶液中水的质量-蒸发的水的质量.
⑤根据铁矿石和钢材中铁的质量相等列出等式.
解答:解:(1)设所需盐酸的体积为x
200g×14.6%=x×1.18g/ml×37%
x=66.9ml
(2)设生成气体的质量为x,样品中铁的质量为y,生成氯化亚铁的质量为z
Fe+2HCl═FeCl2+H2↑
56 73 127 2
y 14.6g z x



y=11.2g z=25.4g
③原样品中单质铁的质量分数= %=97.4%
%=97.4%
④若把反应后溶液蒸发掉10.8g水,则所得溶液中溶质的质量分数= %=25.4%
%=25.4%
⑤设需要赤铁矿的质量为a
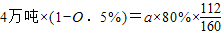
a=7.1万吨
故答案为:(1)66.9
(2)①Fe+2HCl═FeCl2+H2↑②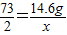 ③97.4%④25.4%⑤7.1万吨
③97.4%④25.4%⑤7.1万吨
点评:本题是一道综合性的计算题,比较难,考查的内容也较多,需要注意的是一般求反应后所得溶液质量的方法是所加入的所有物质的质量总和-生成沉淀的质量-生成气体的质量,而本题中所得溶液的质量却是用最简单的计算方法,即溶质的质量+溶剂的质量.
(2)①此处发生的反应为铁和盐酸发生的反应.
②化学方程式中任意两种物质之间(除催化剂外)都存在固定的比例关系,已知参加反应的盐酸的质量,据此可写出求氢气质量的比例式.
③根据盐酸溶液中溶质的质量可求出单质铁的质量,再根据
 %即可求出样品中单质铁的质量分数.
%即可求出样品中单质铁的质量分数.④溶液中溶质的质量分数=
 %,溶质为氯化亚铁,可根据盐酸溶液中溶质的质量求出,溶液的质量=溶质的质量+溶剂的质量,溶质的质量已知,溶剂的质量=盐酸溶液中水的质量-蒸发的水的质量.
%,溶质为氯化亚铁,可根据盐酸溶液中溶质的质量求出,溶液的质量=溶质的质量+溶剂的质量,溶质的质量已知,溶剂的质量=盐酸溶液中水的质量-蒸发的水的质量.⑤根据铁矿石和钢材中铁的质量相等列出等式.
解答:解:(1)设所需盐酸的体积为x
200g×14.6%=x×1.18g/ml×37%
x=66.9ml
(2)设生成气体的质量为x,样品中铁的质量为y,生成氯化亚铁的质量为z
Fe+2HCl═FeCl2+H2↑
56 73 127 2
y 14.6g z x



y=11.2g z=25.4g
③原样品中单质铁的质量分数=
 %=97.4%
%=97.4%④若把反应后溶液蒸发掉10.8g水,则所得溶液中溶质的质量分数=
 %=25.4%
%=25.4%⑤设需要赤铁矿的质量为a
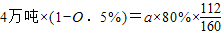
a=7.1万吨
故答案为:(1)66.9
(2)①Fe+2HCl═FeCl2+H2↑②
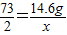 ③97.4%④25.4%⑤7.1万吨
③97.4%④25.4%⑤7.1万吨点评:本题是一道综合性的计算题,比较难,考查的内容也较多,需要注意的是一般求反应后所得溶液质量的方法是所加入的所有物质的质量总和-生成沉淀的质量-生成气体的质量,而本题中所得溶液的质量却是用最简单的计算方法,即溶质的质量+溶剂的质量.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 世界上因锈蚀每年损失钢铁约为产量的20%~40%.现要测定锈蚀的钢铁中铁单
世界上因锈蚀每年损失钢铁约为产量的20%~40%.现要测定锈蚀的钢铁中铁单 世界上因锈蚀每年损失钢铁约为产量的20%~40%.现要测定锈蚀的钢铁中铁单
世界上因锈蚀每年损失钢铁约为产量的20%~40%.现要测定锈蚀的钢铁中铁单
