题目内容
【题目】以某矿渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
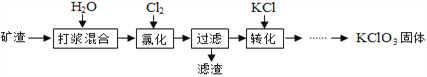
(1)打浆混合的目的是______________________。
(2)氯化过程控制矿渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2、CaCl2和H2O,写出该反应的化学方程式__________________,此反应_________置换反应(选填“属于”“不属于”); 其中Ca(ClO)2进一步转化为Ca(ClO3)2。
(3)氯化时矿渣稍过量的原因是__________________。
(4)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O滤渣的主要成分是____________和______________CaCO3、Ca(OH)2填化学式)。
(5)已知:几种物质的溶解度曲线如图所示。
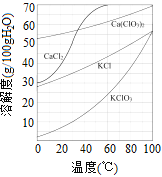
向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若从该溶液中尽可能多地析出KClO3固体的方法是___________、冷却结晶。
【答案】 使矿渣混合均匀,使其反应更充分 2Cl2+2Ca(OH)2==Ca(ClO)2+CaCl2+2H2O 不属于 使Cl2反应完全,防止污染空气 CaCO3 Ca(OH)2 蒸发浓缩
【解析】(1)打浆混合的目的是使矿渣混合均匀,使其反应更充分、更迅速;(2)在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2、CaCl2和H2O,反应的化学方程式2Cl2+2Ca(OH)2==Ca(ClO)2+CaCl2+2H2O;书写化学方程式的步骤一般有四步:1.根据实验事实,在式子的左、右两边分别写出反应物和生成物的化学式,并在式子的左、右两边之间画一条短线;当反应物或生成物有多种时,中间用加号(即“+”)连接起来.2.配平化学方程式,并检查后,将刚才画的短线改写成等号(表示式子左、右两边每一种元素原子的总数相等).3.标明化学反应发生的条件(因为化学反应只有在一定的条件下才能发生);如点燃、加热(常用“△”号表示)、催化剂、通电等.并且,一般都写在等号的上面,若有两个条件,等号上面写一个下面写一个.4.注明生成物中气体或固体的状态符号(即“↑”、“↓”);一般标注在气体或固体生成物的化学式的右边.但是,如果反应物和生成物中都有气体或固体时,其状态符号就不用标注了;由一种单质和一种化合物生成另一种单质和另一种化合物的反应叫置换反应。(3)氯化时矿渣稍过量的原因是使Cl2反应完全,防止污染空气 ;(4)滤渣的主要成分是碳酸钙和氢氧化钙,(5)由图可知,氯酸钙的溶解度受温度的影响很小,而氯酸钾的溶解度受温度的影响较大,且随温度的降低而减小;从该溶液中尽可能多地析出KClO3固体的方法是降温结晶,具体操作是先蒸发浓缩,后冷却结晶,然后过滤。