题目内容
【题目】水是生命之源,工业、农业、生活等各方面都离不开水。
I、下列物质加入水中能形成溶液的是_________,能形成乳浊液的是_________。(填序号)
a.植物油 b.硫酸铜 c.泥土
II、下图是实验室用溶质质量分数为10%的氢氧化钠溶液进行水的电解实验。
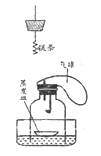
实验一:配制200g溶质质量分数为10%氢氧化钠溶液
(1)所需氢氧化钠的质量是______g;
(2)称量时,氢氧化钠固体应放于天平____(填“左”或“右”)盘上的_______内;量取所需的水时(水的密度为1g/cm3),应选择的量筒的规格是_______mL(选填“100”、“200”或“250”)。
实验二:水的电解实验
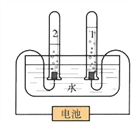
(3)用如图所示装置进行水的电解实验。已知氢氧化钠在水的电解过程中,只是起到了_____________的作用。实验前管1和管2内都装满溶液,接通电源,一段时间后,两管内产生的气体情况如图所示,则管2下方的电极应连接电源的________极(填“正”或“负”),用__________的方法可验证2管中的气体。写出电解水的化学方程式:_____________。
(4)该实验能说明的事实是:___________________________。
(5)电解后溶液的溶质质量分数_____10%(填“<”、“=”或“>”)。
【答案】 b a 20 左 烧杯 200 增强溶液的导电性 负 点燃 略 水是有氢元素和氧元素组成的 >
【解析】I、在一定条件下溶质分散到溶剂中形成的是均一稳定的混合物属于溶液,硫酸铜易溶于水,形成均一、稳定的混合物,属于溶液;植物油不溶于水,与水混合形成乳浊液;
II、(1)氢氧化钠的质量是200g×10%=20g;
(2)天平使用时要“左物右码”,氢氧化钠固体有强腐蚀性,应放于天平左盘上的玻璃器皿(如烧杯)内;需要水的质量为200g-20g=180g,水的密度为1g/cm3,所以水的体积为180mL,量取所需的水时,应选择的量筒的规格是200mL。
(3)电解水时,加入氢氧化钠,目的是增强溶液的导电性;生成氢气和氧气的体积比为2:1,管2中的气体为氢气,与电源的负极相连;氢气具有可燃性,可用点燃的方法验证;电解水的化学方程式为:2H2O ![]() 2H2↑+O2↑;
2H2↑+O2↑;
(4)电解水实验能说明水是有氢元素和氧元素组成的;
(5)电解后,水减少,氢氧化钠的质量不变,溶液的溶质质量分数变大,所以溶液的溶质质量分数>10%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某科学兴趣小组如下图所示装置测定空气中氧气含量,并对剩余的氮气产生了兴趣。查阅资料得知镁可在氧气中燃烧生成氧化镁,镁可在氮气中燃烧生成氮化镁(Mg3N2),设计了如下方案进行验证。
实验装置如图:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、橡皮塞等装配成如图所示的装置。蒸发皿浮在水面上。
实验装置 | 【实验1】测定氧气含量. | 【实验2】验证氮气 |
| I. 引燃燃烧匙中足量的红磷,塞好橡皮塞。 待充分冷却,观察到广口瓶内水面上升的体积约占瓶内水面原上方空间的1/5左右。 II. 往水槽中加水使广口瓶内外水面相平。 | I. 继续【实验1】,更换燃烧下端系镁条的燃烧匙,并点燃镁条。 镁条在广口瓶内继续燃烧,发出红光,蒸发皿中出现淡黄色固体。待冷却后广口瓶内水位继续上升。 II. 取出蒸发皿,滴入几滴水,淡黄色固体变白,闻到刺激性气味气体。 |
(1)连接仪器后,把组装好的无底广口瓶直接压入水槽当中,气球微微鼓起并保持,该现象说明___________。
(2)【实验1】除上表中描述的现象之外,还会观察到的现象为__________;步骤II的目的是______________。
(3)【实验2】中广口瓶内水位继续上升过程中瓶内气压______________(选填“大于”“小于”或“等于”)外界气压。
(4)【反思】同学们在空气中直接燃烧镁条,重复多次仍然未能得到淡黄色固体。与上述实验对比,对此请你给出合理解释__________。

请补充完成【实验2】中步骤II的反应方程式Mg3N2+6H2O==3Mg(OH)2 +2_________。