题目内容
【题目】实验室用高锰酸钾制取氧气的过程如下,正确顺序是( )
①给试管加热;
②熄灭酒精灯;
③检查气密性;
④把高锰酸钾装入试管,在试管口堵一小团棉花, 用带导管的胶塞塞紧,固定在铁架台上;
⑤用排水法收集氧气;
⑥从水中取出导管
A.③④①⑤⑥②B.③④①⑤②⑥C.④①③⑤②⑥D.①①③⑤⑥②
【答案】A
【解析】
实验室加热高锰酸钾制取氧气的操作步骤和注意点分别是:连(连接仪器、组装实验装置)→查(检查装置的气密性)→装(装入固体药品)→定(用铁架台固定仪器装置)→点(用火柴点燃酒精灯,给试管加热)→收(收集氧气)→移(把导管移出水面)→熄(熄灭酒精灯),可得题中正确的操作顺序是:③④①⑤⑥②。故选A。

【题目】某校化学兴趣小组利用下列仪器在实验室进行制取O2的相关实验探究,请回答下列问题。

(1)甲小组用MnO2、KClO3两种药品制取干燥的O2,需选用的仪器组合是_____________,反应结束后回收MnO2固体,操作依次是冷却至室温、___________、过滤、____________、烘干。
(2)乙小组探究Fe2O3能否作为H2O2分解的催化剂。实验时间为30s(H2O2过量),其他可能影响实验的因素均保持不变,相关数据如下:
实验 序号 | 10%的H2O2 溶液(mL) | 溶液中加入 物质(g) | 收集到气体的 体积(mL) |
1 | 100 | 无 | a |
2 | 100 | Fe2O3 0.5g | b |
3 | 100 | MnO2 0.5g | c |
通过比较_______和_______(填“a”“b”“c”)的大小,可证明Fe2O3在实验中起催化作用,写出该反应的化学方程式_______________________________________________。其次需补做实验,验证反应前后Fe2O3的化学性质不变和验证__________________________________。
(3)丙小组探究MnO2的用量对H2O2分解速率的影响。每次均用30mL 10%的H2O2溶液,使用不同质量的MnO2作催化剂,测定每次收集到500mL O2所用的时间。结果如图(其他实验条件相同):
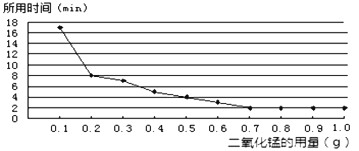
由图可知,MnO2的用量对H2O2分解速率影响的规律是:
①_____________________________________________________;
②MnO2的用量超出一定范围后,其用量再增大,反应速率不再继续加快。