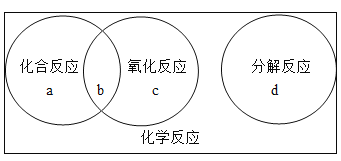
题目内容
【题目】欲测定某铜锌合金中锌的质量分数,进行了如下实验:
(1)配制100g 19.6 %的稀硫酸,需取_____g 98.0 %的浓硫酸加水稀释。
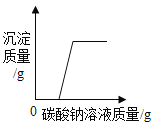
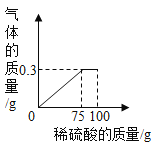
(2)将(1)中配制好的稀硫酸慢慢加入盛有15.0 g铜锌合金样品的烧杯中,产生气体的质量与加入稀硫酸的质量关系如图所示。(化学方程式:Zn+H2SO4=ZnSO4+H2↑) 计算:该铜锌合金中锌的质量分数 ________。
【答案】20g 65%
【解析】
(1)浓硫酸配制稀硫酸,溶液中溶质的质量保持不变,设配制100g 19.6 %的稀硫酸,需取98.0 %的浓硫酸质量为x,则有:![]() ,解得x=20g。
,解得x=20g。
(2)将(1)中配制好的稀硫酸慢慢加入盛有15.0 g铜锌合金样品的烧杯中,产生气体的质量与加入稀硫酸的质量关系如图所示,由图可知产生氢气最多为0.3g,此时锌完全反应,设锌的质量为y,则:

由![]() 解得y=9.75g
解得y=9.75g
样品中锌的质量分数为![]()
答:铜锌合金中锌的质量分数为65%。

【题目】教材“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
(提出问题)氧化铁(化学式Fe2O3)能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
实验步骤 | 实验现象 |
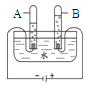
①分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向A试管加入a克氧化铁粉末,并分别在A、B两支试管中插入带火星的木条,观察现象。 | A试管中____,带火星木条复燃。 B试管中无明显现象 |
②待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管内,如此反复多次试验,观察现象。 | 试管内均产生大量气泡。带火星木条均复燃 |
③将实验②中的剩余物小心过滤,并将所得滤渣进行过滤、洗涤、干燥、________。 | 所得固体质量仍为a克 |
④分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中放入a克氧化铁粉末,向D试管中加入a克二氧化锰粉末,观察现象。 | 现象略 |
(1)①中A试管的现象是____;
(2)表格中缺失的步骤为___;
(3)(实验结论)实验②、③证明:氧化铁的______和___在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(4)写出氧化铁催化过氧化氢的化学反应文字表达式___;
(5)(实验评论)实验设计④的目的是____。
(6)(知识拓展)查阅资料得知,氧化铜、硫酸铜溶液、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂,下列有关催化剂的说法正确的是____;
A 同一个化学反应可以有多种催化剂
B MnO2只能作为氧化氢溶液分解的催化剂
C 催化剂只加快反应速率
D 作催化剂的物质不能是其他反应的反应物或生成物.