题目内容
用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实验.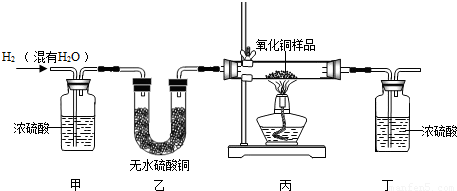
(1)在实验中,乙装置的作用是______.
(2)准确称取完全反应前后装置丙和丁的质量如表:
| 装置丙 | 装置丁 | |
| 反应前 | 48.8克 | 161.2克 |
| 反应后 | 46.5克 | 163.9克 |
小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度(写出计算过程).
(3)比较两种计算结果,请分析导致这一结果的原因可能是______.
A.装置的气密性不好 B.空气中的水分被丁处浓硫酸吸收
C.通入的氢气量不足 D.空气中的二氧化碳被丁处浓硫酸吸收.
【答案】分析:(1)根据无水硫酸铜遇到水变蓝的特性考虑;(2)根据浓硫酸具有吸水性,根据浓硫酸质量的增加量就是生成的水的质量,再根据水的质量计算出氧化铜的质量,再计算纯度;(3)根据丁装置能吸收空气中水分考虑.
解答:解:(1)氢气通过浓硫酸是为了除去氢气中的水分,无水硫酸铜遇到水由白色变蓝,所以通过无水硫酸铜就是检验浓硫酸是否把氢气中水分除尽;
(2)根据浓硫酸质量的增加量就是生成的水的质量,所以生成水的质量为:163.9g-161.2g=2.7g,设要生成2.7g水需要参加反应的氧化铜的质量为X则:
H2+CuO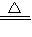 Cu+H2O
Cu+H2O
80 18
X 2.7g
根据: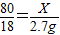 解得X=12g,所以氧化铜的质量分数:
解得X=12g,所以氧化铜的质量分数: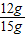 ×100%=80%
×100%=80%
答:氧化铜样品的纯度为80%.
(3)根据浓硫酸质量的增加量计算结果偏大,原因是浓硫酸与空气通着,吸收了空气中的水分.
故答案为:(1)检验氢气中水分是否全部被吸收;(2)80%;(3)B.
点评:本题容易出错的地方是对两种做法不同的原因分析,要考虑浓硫酸的吸水性,不仅吸收了生成的水,连空气中的水也吸收了.
解答:解:(1)氢气通过浓硫酸是为了除去氢气中的水分,无水硫酸铜遇到水由白色变蓝,所以通过无水硫酸铜就是检验浓硫酸是否把氢气中水分除尽;
(2)根据浓硫酸质量的增加量就是生成的水的质量,所以生成水的质量为:163.9g-161.2g=2.7g,设要生成2.7g水需要参加反应的氧化铜的质量为X则:
H2+CuO
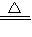 Cu+H2O
Cu+H2O80 18
X 2.7g
根据:
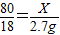 解得X=12g,所以氧化铜的质量分数:
解得X=12g,所以氧化铜的质量分数: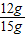 ×100%=80%
×100%=80%答:氧化铜样品的纯度为80%.
(3)根据浓硫酸质量的增加量计算结果偏大,原因是浓硫酸与空气通着,吸收了空气中的水分.
故答案为:(1)检验氢气中水分是否全部被吸收;(2)80%;(3)B.
点评:本题容易出错的地方是对两种做法不同的原因分析,要考虑浓硫酸的吸水性,不仅吸收了生成的水,连空气中的水也吸收了.

练习册系列答案
相关题目
碱式碳酸铜是一种绿色的固体,受热分解成黑色固体物质、二氧化碳和水.这种黑色固体的成分是什么呢?亮亮与间学们进行以下探究:
[猜想]:该黑色固体可能氧化铜,也可能是氧化铜和炭的混合物.
[设计与实验]
接着小明与同学们用氢气还原氧化铜制取铜.
(1)要制得纯净的氢气,小明应选用的药品是______
A、铁和稀硫酸 B、锌和浓盐酸 C、镁和稀硫酸D、锌和稀硫酸
(2)实验开始时,应先通入一会儿______,然后再加热,这样操作的目的是______
(3)实验结束后,小方同学对还原后的红色物质产生了兴趣,该红色物质一定是单质铜吗?
查阅有关资料获知:氢气与氧化铜在加热条件下能生成氧化亚铜(Cu2O),氧化亚铜也呈红色,且能与稀硫酸反应生成硫酸铜、铜和水.
为此,小方同学靠后做了两次实验,第一次称取4.0g氧化铜进行实验,得到了3.3g红色物质;第二次同样用4.0g氧化铜进行实验,得到了3.2g红色物质.
①小方通过对所得实验数据迸行计算分析后知t第二次实验得到的红色物质全部是铜,第一次得到的红色物质除铜外,还含有氧化亚铜.小方的分析依据是______.
②随后,他用化学实验方法验证了上述分析结果的正确性.其验证方法是(简要写出操作现象、结论)______
③从上述实验中,小方获得以下结论:在氢气还原氧化铜实验中,若还原不充分,一会得到红色氧化亚铜,请写出氢气还原氧化铜生成氧化亚铜的化学方程式______ Cu2O+H2O
[猜想]:该黑色固体可能氧化铜,也可能是氧化铜和炭的混合物.
[设计与实验]
| 实验步骤 | 实验现象 | 结论和化学方程式 |
| 亮亮同学取少量黑色固体,放入试管中,加入足量的稀硫酸,微热. | 黑色固体完全消失,溶液变______色. | 此黑色固体是氧化铜.该反应的化学方程式为______ |
(1)要制得纯净的氢气,小明应选用的药品是______
A、铁和稀硫酸 B、锌和浓盐酸 C、镁和稀硫酸D、锌和稀硫酸
(2)实验开始时,应先通入一会儿______,然后再加热,这样操作的目的是______
(3)实验结束后,小方同学对还原后的红色物质产生了兴趣,该红色物质一定是单质铜吗?
查阅有关资料获知:氢气与氧化铜在加热条件下能生成氧化亚铜(Cu2O),氧化亚铜也呈红色,且能与稀硫酸反应生成硫酸铜、铜和水.
为此,小方同学靠后做了两次实验,第一次称取4.0g氧化铜进行实验,得到了3.3g红色物质;第二次同样用4.0g氧化铜进行实验,得到了3.2g红色物质.
①小方通过对所得实验数据迸行计算分析后知t第二次实验得到的红色物质全部是铜,第一次得到的红色物质除铜外,还含有氧化亚铜.小方的分析依据是______.
②随后,他用化学实验方法验证了上述分析结果的正确性.其验证方法是(简要写出操作现象、结论)______
③从上述实验中,小方获得以下结论:在氢气还原氧化铜实验中,若还原不充分,一会得到红色氧化亚铜,请写出氢气还原氧化铜生成氧化亚铜的化学方程式______ Cu2O+H2O
碱式碳酸铜是一种绿色的固体,受热分解成黑色固体物质、二氧化碳和水.这种黑色固体的成分是什么呢?亮亮与间学们进行以下探究:
[猜想]:该黑色固体可能氧化铜,也可能是氧化铜和炭的混合物.
[设计与实验]
接着小明与同学们用氢气还原氧化铜制取铜.
(1)要制得纯净的氢气,小明应选用的药品是______
A、铁和稀硫酸 B、锌和浓盐酸 C、镁和稀硫酸D、锌和稀硫酸
(2)实验开始时,应先通入一会儿______,然后再加热,这样操作的目的是______
(3)实验结束后,小方同学对还原后的红色物质产生了兴趣,该红色物质一定是单质铜吗?
查阅有关资料获知:氢气与氧化铜在加热条件下能生成氧化亚铜(Cu2O),氧化亚铜也呈红色,且能与稀硫酸反应生成硫酸铜、铜和水.
为此,小方同学靠后做了两次实验,第一次称取4.0g氧化铜进行实验,得到了3.3g红色物质;第二次同样用4.0g氧化铜进行实验,得到了3.2g红色物质.
①小方通过对所得实验数据迸行计算分析后知t第二次实验得到的红色物质全部是铜,第一次得到的红色物质除铜外,还含有氧化亚铜.小方的分析依据是______.
②随后,他用化学实验方法验证了上述分析结果的正确性.其验证方法是(简要写出操作现象、结论)______
③从上述实验中,小方获得以下结论:在氢气还原氧化铜实验中,若还原不充分,一会得到红色氧化亚铜,请写出氢气还原氧化铜生成氧化亚铜的化学方程式______ Cu2O+H2O
[猜想]:该黑色固体可能氧化铜,也可能是氧化铜和炭的混合物.
[设计与实验]
| 实验步骤 | 实验现象 | 结论和化学方程式 |
| 亮亮同学取少量黑色固体,放入试管中,加入足量的稀硫酸,微热. | 黑色固体完全消失,溶液变______色. | 此黑色固体是氧化铜.该反应的化学方程式为______ |
(1)要制得纯净的氢气,小明应选用的药品是______
A、铁和稀硫酸 B、锌和浓盐酸 C、镁和稀硫酸D、锌和稀硫酸
(2)实验开始时,应先通入一会儿______,然后再加热,这样操作的目的是______
(3)实验结束后,小方同学对还原后的红色物质产生了兴趣,该红色物质一定是单质铜吗?
查阅有关资料获知:氢气与氧化铜在加热条件下能生成氧化亚铜(Cu2O),氧化亚铜也呈红色,且能与稀硫酸反应生成硫酸铜、铜和水.
为此,小方同学靠后做了两次实验,第一次称取4.0g氧化铜进行实验,得到了3.3g红色物质;第二次同样用4.0g氧化铜进行实验,得到了3.2g红色物质.
①小方通过对所得实验数据迸行计算分析后知t第二次实验得到的红色物质全部是铜,第一次得到的红色物质除铜外,还含有氧化亚铜.小方的分析依据是______.
②随后,他用化学实验方法验证了上述分析结果的正确性.其验证方法是(简要写出操作现象、结论)______
③从上述实验中,小方获得以下结论:在氢气还原氧化铜实验中,若还原不充分,一会得到红色氧化亚铜,请写出氢气还原氧化铜生成氧化亚铜的化学方程式______ Cu2O+H2O