题目内容
 小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.小刚叫来小军和小红,共同探究这种白色粉末的成分.
小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.小刚叫来小军和小红,共同探究这种白色粉末的成分.
他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:
①可能是NaOH; ②可能是Na2CO3; ③可能是________.
为了验证猜想,他们分别做了下面的实验.
(1)小军取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色.由此小军认为白色粉末是NaOH.请判断小刚所得结论是否正确,并述说理由________.
(2)小红取少量白色粉末溶于水,向所得溶液中滴加BaCl2试液,有白色沉淀产生.由此判断白色粉末中含有________.为了验证猜想③,小红继续向溶液中滴加BaCl2试液至不再产生沉淀,然后过滤.你认为她接下来还应进行的实验是________;
(3)在小红所做的实验中,若把BaCl2溶液换成Ba(OH)2溶液是否可行?________请简述理由________.
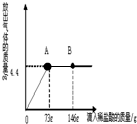
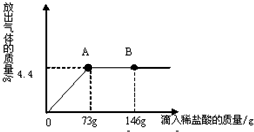
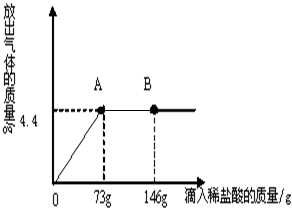
(4)在一烧杯中盛有22.3g Na2CO3和NaCl组成的固体混合物,加43.1g水溶解,制成溶液.向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示:回答问题:
①当滴加了73g稀盐酸时,放出气体的质量为________ g.
②当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是(写化学式)________.
③当滴加了73g稀盐酸时(即A点时),烧杯中为不饱和溶液,通过计算求出其中含溶质的质量分数是________多少?(计算结果精确到0.1%)
解:
氢氧化钠也可能部分变质,也可能是氢氧化钠和碳酸钠的混合物;
故答案为:NaOH和Na2CO3;
(1)碳酸钠水溶液呈强碱性,也能使无色酚酞溶液,变为红色;
故答案为:Na2CO3溶液也呈碱性,也能使酚酞变红;
(2)碳酸钠与氯化钡反应可生成碳酸钡白色沉淀,所以取少量白色粉末溶于水,向所得溶液中滴加BaCl2试液,有白色沉淀产生,由此判断白色粉末中含有Na2CO3;碱能使无色酚酞溶液变为红色,因此可以向滤液中滴加无色酚酞溶液,进行检验;
故答案为:Na2CO3;在滤液中滴加酚酞溶液;
(3)碳酸钠与氢氧化钡反应生成氢氧化钠和碳酸钡,可以判断白色粉末中含有Na2CO3;但是该反应生成氢氧化钠,无论原白色粉末中是否含有氢氧化钠,酚酞都会变红,影响氢氧化钠的鉴定,无法证明粉末中是否含有氢氧化钠;
故答案为:
不行; 反应会生成NaOH;
(4))①观察图象可知:生成气体的质量是4.4g;
②观察图象可知:当滴加稀盐酸至图中B点时,稀盐酸过量,溶液中有盐酸和反应生成的氯化钠;
③设白色粉末中碳酸钠的质量是x,生成氯化钠的质量是y
Na2CO3 +2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
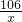 =
=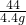
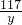 =
=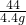
x=10.6g y=11.7g
∴混合物中氯化钠的质量是:22.3g-10.6g=11.7g
A点时溶液中溶质质量分数是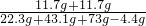 ×100%=17.5%
×100%=17.5%
故答案为:①4.4g;②HCl、NaCl;③17.5%.
分析:氢氧化钠可能部分变质,也可能是氢氧化钠和碳酸钠的混合物;
(1)碳酸钠水溶液呈碱性,能使无色酚酞溶液,变为红色;
(2)碳酸钠与氯化钡反应生成碳酸钡白色沉淀;碱能使无色酚酞溶液变为红色;
(3)碳酸钠与氢氧化钡反应生成氢氧化钠,影响氢氧化钠的鉴定;
(4)①观察图象可知:生成气体的质量是4.4g;
②观察图象可知:当滴加稀盐酸至图中B点时,稀盐酸过量,溶液中有稀盐酸和反应生成的氯化钠;
③根据生成气体的质量结合方程式计算混合物中碳酸钠的质量,生成的氯化钠的质量,然后依据溶质的质量分数的计算式求出溶液中溶质的质量分数.
点评:本题考查学生对碳酸钠的检验方法的理解与掌握,同时考查了学生依据方程式进行计算的能力,知识综合,能较好的考查出学生对知识的掌握和应用能力.
氢氧化钠也可能部分变质,也可能是氢氧化钠和碳酸钠的混合物;
故答案为:NaOH和Na2CO3;
(1)碳酸钠水溶液呈强碱性,也能使无色酚酞溶液,变为红色;
故答案为:Na2CO3溶液也呈碱性,也能使酚酞变红;
(2)碳酸钠与氯化钡反应可生成碳酸钡白色沉淀,所以取少量白色粉末溶于水,向所得溶液中滴加BaCl2试液,有白色沉淀产生,由此判断白色粉末中含有Na2CO3;碱能使无色酚酞溶液变为红色,因此可以向滤液中滴加无色酚酞溶液,进行检验;
故答案为:Na2CO3;在滤液中滴加酚酞溶液;
(3)碳酸钠与氢氧化钡反应生成氢氧化钠和碳酸钡,可以判断白色粉末中含有Na2CO3;但是该反应生成氢氧化钠,无论原白色粉末中是否含有氢氧化钠,酚酞都会变红,影响氢氧化钠的鉴定,无法证明粉末中是否含有氢氧化钠;
故答案为:
不行; 反应会生成NaOH;
(4))①观察图象可知:生成气体的质量是4.4g;
②观察图象可知:当滴加稀盐酸至图中B点时,稀盐酸过量,溶液中有盐酸和反应生成的氯化钠;
③设白色粉末中碳酸钠的质量是x,生成氯化钠的质量是y
Na2CO3 +2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
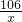 =
=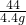
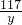 =
=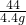
x=10.6g y=11.7g
∴混合物中氯化钠的质量是:22.3g-10.6g=11.7g
A点时溶液中溶质质量分数是
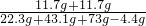 ×100%=17.5%
×100%=17.5%故答案为:①4.4g;②HCl、NaCl;③17.5%.
分析:氢氧化钠可能部分变质,也可能是氢氧化钠和碳酸钠的混合物;
(1)碳酸钠水溶液呈碱性,能使无色酚酞溶液,变为红色;
(2)碳酸钠与氯化钡反应生成碳酸钡白色沉淀;碱能使无色酚酞溶液变为红色;
(3)碳酸钠与氢氧化钡反应生成氢氧化钠,影响氢氧化钠的鉴定;
(4)①观察图象可知:生成气体的质量是4.4g;
②观察图象可知:当滴加稀盐酸至图中B点时,稀盐酸过量,溶液中有稀盐酸和反应生成的氯化钠;
③根据生成气体的质量结合方程式计算混合物中碳酸钠的质量,生成的氯化钠的质量,然后依据溶质的质量分数的计算式求出溶液中溶质的质量分数.
点评:本题考查学生对碳酸钠的检验方法的理解与掌握,同时考查了学生依据方程式进行计算的能力,知识综合,能较好的考查出学生对知识的掌握和应用能力.

练习册系列答案
相关题目
 小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.小刚叫来小军和小红,共同探究这种白色粉末的成分.
小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.小刚叫来小军和小红,共同探究这种白色粉末的成分.