��Ŀ����
11��С���ڻ�ѧʵ���ҷ��֣�ʢ��NaOH��Һ���Լ�ƿƿ�ں���Ƥ���ϳ����˰�ɫ��ĩ��С�ս���С����С�죬��ͬ̽�����ְ�ɫ��ĩ�ijɷ֣�
����������ѧ�Ļ�ѧ֪ʶ�������ְ�ɫ��ĩ�ijɷ��������²��룺
�ٿ�����NaOH �ڿ�����Na2CO3�ۿ�����NaOH��Na2CO3�Ļ���
Ϊ����֤���룬���Ƿֱ����������ʵ�飺
��1��С��ȡ������ɫ��ĩ���μ�ϡ���ᣬ���������ɣ��ɴ�С����Ϊ��ɫ��ĩ��Na2CO3��
���ж�С�����ý����Ƿ���ȷ�����������ɣ�
��2��С��ȡ������ɫ��ĩ����ˮ����������Һ�еμӷ�̪��Һ����Һ��Ϊ��ɫ���ɴ�С����Ϊ��ɫ��ĩ��NaOH�����ж�С�����ý����Ƿ���ȷ�����������ɣ�
��3��С��ȡ������ɫ��ĩ����ˮ����������Һ�еμ�BaCl2��Һ���а�ɫ�����������ɴ��жϰ�ɫ��ĩ�к���
��С��������ʵ���У�����BaCl2��Һ����Ba��OH��2��Һ�Ƿ���У���������ɣ�
����������ѧ�Ļ�ѧ֪ʶ�������ְ�ɫ��ĩ�ijɷ��������²��룺
�ٿ�����NaOH �ڿ�����Na2CO3�ۿ�����NaOH��Na2CO3�Ļ���
Ϊ����֤���룬���Ƿֱ����������ʵ�飺
��1��С��ȡ������ɫ��ĩ���μ�ϡ���ᣬ���������ɣ��ɴ�С����Ϊ��ɫ��ĩ��Na2CO3��
���ж�С�����ý����Ƿ���ȷ�����������ɣ�
����ȷ���������Ҳ��
����2��С��ȡ������ɫ��ĩ����ˮ����������Һ�еμӷ�̪��Һ����Һ��Ϊ��ɫ���ɴ�С����Ϊ��ɫ��ĩ��NaOH�����ж�С�����ý����Ƿ���ȷ�����������ɣ�
����ȷ��̼����Ҳ�ʼ���
����3��С��ȡ������ɫ��ĩ����ˮ����������Һ�еμ�BaCl2��Һ���а�ɫ�����������ɴ��жϰ�ɫ��ĩ�к���
̼����
��Ϊ����֤����ۣ�С���������Һ�еμ�BaCl2��Һ�����ٲ���������Ȼ����ˣ�����Ϊ����������Ӧ���е�ʵ��������Һ�еη�̪����ʯ���Һ
����С��������ʵ���У�����BaCl2��Һ����Ba��OH��2��Һ�Ƿ���У���������ɣ�
��������1��̼���ƺ����ᷴӦ�������Ȼ��ơ�ˮ�Ͷ�����̼���������ƺ����ᷴӦ�����Ȼ��ƺ�ˮ��
��2������������Һ�ʼ�����ʹ��ɫ��̪��ɺ�ɫ��̼�����������������ʣ�������ҺҲ�ʼ�����ʹ��ɫ��̪��죻
��3��̼������Һ�������Ȼ�����Ӧ����̼�ᱵ�������Ȼ��ƣ��Ȼ�����Һ�����ԣ��������������Ȼ������ϸ��ֽⷴӦ���������������ܷ�����Ӧ����������Ҳ����̼���Ʒ�Ӧ����̼�ᱵ�������������ƣ�
��2������������Һ�ʼ�����ʹ��ɫ��̪��ɺ�ɫ��̼�����������������ʣ�������ҺҲ�ʼ�����ʹ��ɫ��̪��죻
��3��̼������Һ�������Ȼ�����Ӧ����̼�ᱵ�������Ȼ��ƣ��Ȼ�����Һ�����ԣ��������������Ȼ������ϸ��ֽⷴӦ���������������ܷ�����Ӧ����������Ҳ����̼���Ʒ�Ӧ����̼�ᱵ�������������ƣ�
����⣺��1����ɫ��ĩ�μ�ϡ�������������ɣ�˵������Na2CO3����������֤��ֻ��Na2CO3�����ߵĻ����Ҳ���Բ������壻
�ʴ�Ϊ������ȷ���������Ҳ�ɣ�
��2����������Һ�еμӷ�̪��Һ����Һ��Ϊ��ɫ��˵����Һ�Ǽ�����Һ����Na2CO3��ҺҲ�Լ��ԣ��ʲ���ȷ����ɫ��ĩ����NaOH��
�ʴ�Ϊ������ȷ��̼����Ҳ�ʼ��ԣ�
��3���μ�BaCl2��Һ���а�ɫ����������˵��������Ba2CO3�����������жϰ�ɫ��ĩ�к���Na2CO3�����������ٲ�������˳�����ҺӦ�η�̪����ʯ���Һ�������Һ�Լ��ԣ�˵����ɫ��ĩ�л�����NaOH������ɫ˵���Ǵ�����Na2CO3��ĩ��
�ʴ�Ϊ��̼���ƣ�����Һ�еη�̪����ʯ���Һ��
��������������Һ�����Ȼ�����Һ����������������̼���Ʒ�Ӧ�����˳ʼ��Ե��������ƣ���ˣ���Ӧ���ٵ����̪Ҳ����֤��ԭ��Һ���Ƿ����������ƣ�
�ʴ�Ϊ�����ɣ������������ƣ�Ӱ����������Ƶ�ȷ����
�ʴ�Ϊ������ȷ���������Ҳ�ɣ�
��2����������Һ�еμӷ�̪��Һ����Һ��Ϊ��ɫ��˵����Һ�Ǽ�����Һ����Na2CO3��ҺҲ�Լ��ԣ��ʲ���ȷ����ɫ��ĩ����NaOH��
�ʴ�Ϊ������ȷ��̼����Ҳ�ʼ��ԣ�
��3���μ�BaCl2��Һ���а�ɫ����������˵��������Ba2CO3�����������жϰ�ɫ��ĩ�к���Na2CO3�����������ٲ�������˳�����ҺӦ�η�̪����ʯ���Һ�������Һ�Լ��ԣ�˵����ɫ��ĩ�л�����NaOH������ɫ˵���Ǵ�����Na2CO3��ĩ��
�ʴ�Ϊ��̼���ƣ�����Һ�еη�̪����ʯ���Һ��
��������������Һ�����Ȼ�����Һ����������������̼���Ʒ�Ӧ�����˳ʼ��Ե��������ƣ���ˣ���Ӧ���ٵ����̪Ҳ����֤��ԭ��Һ���Ƿ����������ƣ�
�ʴ�Ϊ�����ɣ������������ƣ�Ӱ����������Ƶ�ȷ����
������̼������Һ�ʼ��ԣ���ʹ��ɫ��̪��죻̼���ƿ������ᷴӦ�ų�������̼��������ε��γɳ���������ڼ�������ʱ��̼���Ƴ����ر����ã�

��ϰ��ϵ�д�
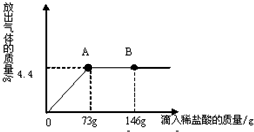
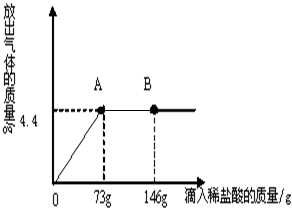
 Сѧ���AB��ϵ�д�
Сѧ���AB��ϵ�д�
�����Ŀ
 С���ڻ�ѧʵ���ҷ��֣�ʢ��NaOH��Һ���Լ�ƿƿ�ں���Ƥ���ϳ����˰�ɫ��ĩ��С�ս���С����С�죬��ͬ̽�����ְ�ɫ��ĩ�ijɷ֣�
С���ڻ�ѧʵ���ҷ��֣�ʢ��NaOH��Һ���Լ�ƿƿ�ں���Ƥ���ϳ����˰�ɫ��ĩ��С�ս���С����С�죬��ͬ̽�����ְ�ɫ��ĩ�ijɷ֣�