题目内容
【题目】通过比较相同时间内产生氧气的体积可探究影响过氧化氢分解速率的因素。
(1)用以下装置进行实验并绘制曲线如图。
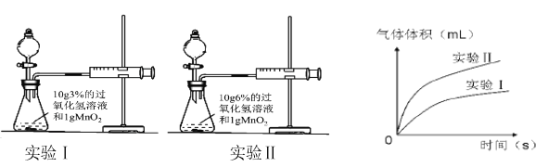
根据上图信息可知,该因素对过氧化氢分解速率的影响是 。
(2)探究温度及催化剂质量的影响。请补填实验V中的数据。
实验编号 | 温度 | 催化剂 | 过氧化氢溶液的质量及浓度 |
实验Ⅲ | 50℃ | 1g二氧化锰 | 10g,3% |
实验Ⅳ | 25℃ | 2g二氧化锰 | 10g,3% |
实验Ⅴ | 10g,3% |
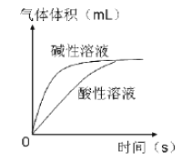
(3)溶液酸碱性对过氧化氢的分解速率也有影响。
①分析下图,可得出的结论是 。
②资料表明:过氧化钡(![]() )与硫酸(
)与硫酸(![]() )溶液反应可用来制取
)溶液反应可用来制取![]() ,同时生成一种白色沉淀硫酸钡(
,同时生成一种白色沉淀硫酸钡(![]() ),该反应的化学方程式为 ;从反应后的混合物中除去硫酸钡沉淀的实验操作是 ;根据①中结论可知,利用上述反应制取
),该反应的化学方程式为 ;从反应后的混合物中除去硫酸钡沉淀的实验操作是 ;根据①中结论可知,利用上述反应制取![]() 时,所加硫酸的量应 (填“少量”或“过量”)。
时,所加硫酸的量应 (填“少量”或“过量”)。
【答案】(1) 在相同条件下,过氧化氢溶液的浓度越大,其分解速率越快;(2) 50℃(或25℃);2g(或1g); (3) ①碱性溶液中过氧化氢分解的速率比酸性溶液中快,但不影响生成物的量;②![]() ;过滤;过量.
;过滤;过量.
【解析】(1)根据上图信息可知,实验Ⅱ比实验Ⅰ的反应速率快,因此过氧化氢溶液的浓度越大,其分解速率越快;(2)实验Ⅲ和Ⅳ中溶液的温度和催化剂的量都不相同,所以实验Ⅴ中应该选择温度为50℃(或25℃),催化剂为2g(或1g),由此实验Ⅲ和Ⅴ是温度和浓度相同,催化剂的量不同,可以探究催化剂质量对反应速率的影响;实验Ⅳ和Ⅴ是催化剂的质量和浓度相同,可以探究温度对反应速率的影响.
(3) ①由图示信息可知,碱性溶液中过氧化氢分解的速率比酸性溶液中快,但不影响生成物的量;②过氧化钡与硫酸反应制取过氧化氢,同时生成硫酸钡,方程式为:![]() ;从反应后的固液混合物中除去硫酸钡沉淀可采用过滤的实验操作;根据①中结论可知,利用上述反应制取过氧化氢时,为抑制过氧化氢的分解,所以应加入过量的硫酸.
;从反应后的固液混合物中除去硫酸钡沉淀可采用过滤的实验操作;根据①中结论可知,利用上述反应制取过氧化氢时,为抑制过氧化氢的分解,所以应加入过量的硫酸.
试题分析:(1)根据图示信息可推断实验Ⅱ比实验Ⅰ的反应速率快的原因与溶液的浓度有关;(2)根据表格中提
供的数据,结合控制变量时的变量分析;(3)根据图示信息结合催化剂的特点和作用分析;根据反应物与生成物
种类,结合质量守恒定律书写化学方程式,根据过氧化氢在酸性条件下相对稳定分析药品用量.
考点:影响反应速率的因素;催化剂的概念及作用;方程式的书写方法