题目内容
【题目】人类的生产和生活都离不开水,2013年8月起,浦东居民全部喝上了青草沙优质水。
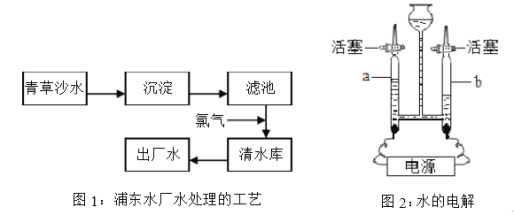
①在图1中,氯气的作用是 ,出厂水是 (填“纯净物”或“混合物”)。
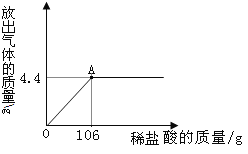
②图2的实验中,反应的化学方程式为 ,检验a管中气体的方法是 。
③青草沙水含氯化钠、氯化钾和硫酸锂等矿物质。
根据下图回答问题:
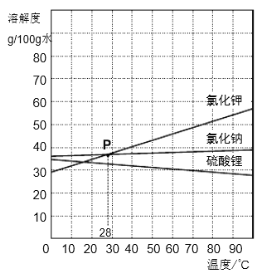
Ⅰ.随温度升高,硫酸锂溶解度的变化趋势是 。
Ⅱ.40℃时,12g氯化钾固体溶于25g水中,成分搅拌,所得溶液的溶质质量分数为 。
Ⅲ.上图中P点的含义是 。
Ⅳ.分别将100g氯化钠、硫酸锂的饱和溶液从80℃降温至10℃,对所得溶液的叙述正确的是 。
A.两者均为饱和溶液
B.溶液质量:氯化钠<硫酸锂
C.溶剂质量:两者相等
D.溶质质量分数:氯化钠>硫酸锂
【答案】①杀菌消毒;混合物;②![]() ;把带火星的木条放在a的管口,观察现象;
;把带火星的木条放在a的管口,观察现象;
③Ⅰ. 随温度的升高而逐渐减小;Ⅱ. 28.6%;Ⅲ. 28℃时氯化钾与氯化钠的溶解度相等;Ⅳ.BD
【解析】①在图1中,氯气的作用是杀菌消毒,出厂水依然含有一些可溶性物质,属于混合物;
②图2是水电解的实验,反应的化学方程式为:![]() ,由图示可知a中气体较少,为氧气,检验氧气的方法是打开活塞,把带火星的木条放在a的排气管口,观察现象;③Ⅰ.随温度升高,硫酸锂溶解度随温度的升高而逐渐减小;Ⅱ.40℃时,氯化钾的溶解度为40g,所以12g氯化钾固体溶于25g水中达到饱和状态且有2g溶质剩余,因此所得溶液的溶质质量分数为
,由图示可知a中气体较少,为氧气,检验氧气的方法是打开活塞,把带火星的木条放在a的排气管口,观察现象;③Ⅰ.随温度升高,硫酸锂溶解度随温度的升高而逐渐减小;Ⅱ.40℃时,氯化钾的溶解度为40g,所以12g氯化钾固体溶于25g水中达到饱和状态且有2g溶质剩余,因此所得溶液的溶质质量分数为![]() 100%=28.6%Ⅲ.右图中P点的含义表示28℃时氯化钾与氯化钠的溶解度相等;Ⅳ.分别将100g氯化钠、硫酸锂的饱和溶液从80℃降温至10℃,因为氯化钠的溶解度随温度的降低而减小,所以溶液中有溶质析出,仍为饱和状态,溶质、溶液质量减少,溶质质量分数减小,硫酸锂的溶解度随温度的降低而增大,所以溶液由饱和状态变为不饱和状态,溶液中的其他量没有发生变化;又因为80℃、10℃时氯化钠的溶解度的大于硫酸锂的溶解度,所以氯化钠饱和溶液中溶剂质量小于硫酸锂溶液中所含的溶剂质量,溶质质量分数也是氯化钠大于硫酸锂,故叙述正确的是BD.
100%=28.6%Ⅲ.右图中P点的含义表示28℃时氯化钾与氯化钠的溶解度相等;Ⅳ.分别将100g氯化钠、硫酸锂的饱和溶液从80℃降温至10℃,因为氯化钠的溶解度随温度的降低而减小,所以溶液中有溶质析出,仍为饱和状态,溶质、溶液质量减少,溶质质量分数减小,硫酸锂的溶解度随温度的降低而增大,所以溶液由饱和状态变为不饱和状态,溶液中的其他量没有发生变化;又因为80℃、10℃时氯化钠的溶解度的大于硫酸锂的溶解度,所以氯化钠饱和溶液中溶剂质量小于硫酸锂溶液中所含的溶剂质量,溶质质量分数也是氯化钠大于硫酸锂,故叙述正确的是BD.
试题分析:①根据氯气的性质和用途分析,根据纯净物含一种物质,混合物含有多种物质分析;②根据电解水实验的现象可以描述为:“正氧负氢,氢二氧一”分析;根据氧气具有助燃性,检验用带火星的木条分析;③根据溶解度曲线表示的意义分析;根据饱和溶液中溶质质量分数=![]() 计算溶液的溶质质量分数;根据不同温度下,物质的溶解度分析改变温度后,溶液中溶质、溶剂、溶质质量分数及状态的变化情况.
计算溶液的溶质质量分数;根据不同温度下,物质的溶解度分析改变温度后,溶液中溶质、溶剂、溶质质量分数及状态的变化情况.
考点:水的净化方法;纯净物与混合物的区别;电解水的实验现象及气体的检验方法;溶解度曲线表示的意义及其应用;饱和溶液与不饱和溶液的特点;物质的结晶方法

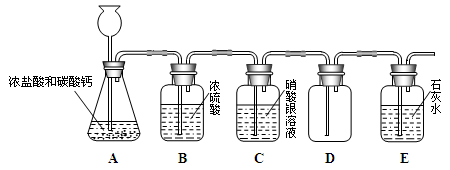
【题目】二氧化硫是造成酸雨的主要物质之一。小丽为探究二氧化硫能与水反应生成酸,设计了如下实验方案。
【实验设计】她先用紫色石蕊溶液将白色滤纸浸润,干燥后做成紫色的小花,然后按下列图示进行实验。观察到实验(I)和(III)中的小花变红,(II)中的小花不变色。

【评价反思】小虎对小丽的实验方案提出了质疑,他认为上述实验不足以证明“二氧化硫和水反应生成了酸”。两位同学仔细讨论后认为还需补充如下一个实验,才能得出二氧化硫与水反应生成酸。
实验操作 | 实验现象 |
__________________ | __________________ |
【拓展应用】二氧化硫也是实验室一种污染气体,常用碱液吸收。写出实验室用氢氧化钠溶液吸收二氧化硫的化学方程式:_____________________________________________.