题目内容
学了催化剂的知识后,某同学联想氧化铜能否对过氧化氢起催化作用呢?于是进行了以下探究,请你参与他的探究.
【猜想】
Ⅰ.氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ.氧化铜是反应的催化剂,反应前后
【实验】用天平称量0.2g氧化铜,取5mL5%的过氧化氢溶液于试管中,进行如下实验: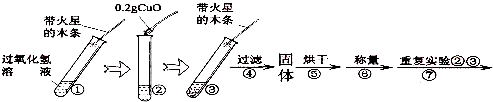
(1)填写下表空格:
(2)步骤①的目的是
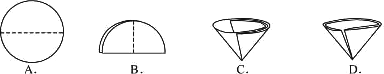
(3)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是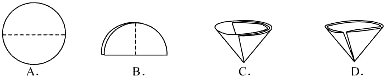
(4)若在④中发现滤纸和漏斗间有气泡,可能的影响是
【猜想】
Ⅰ.氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ.氧化铜是反应的催化剂,反应前后
质量和化学性质不变
质量和化学性质不变
.【实验】用天平称量0.2g氧化铜,取5mL5%的过氧化氢溶液于试管中,进行如下实验:

(1)填写下表空格:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 溶液中 有气泡放出 有气泡放出 带火星的木条复燃. |
0.2g 0.2g |
溶液中有气泡放出, 带火星的木条复燃 带火星的木条复燃 |
猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立. |
与③对比检验氧化铜能否加快双氧水的分解
与③对比检验氧化铜能否加快双氧水的分解
步骤⑦的目的是证明氧化铜的化学性质在反应前后没有改变
证明氧化铜的化学性质在反应前后没有改变
.(3)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是
D
D
(填序号).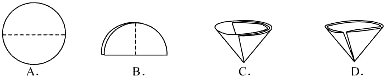
(4)若在④中发现滤纸和漏斗间有气泡,可能的影响是
过滤速度慢
过滤速度慢
,处理的方法是用玻璃棒轻压(使滤纸紧贴漏斗内壁)
用玻璃棒轻压(使滤纸紧贴漏斗内壁)
.分析:Ⅲ、根据催化剂的定义回答;
(1)根据氧化铜对过氧化氢的分解有催化作用回答③现象;根据催化剂的定义和特点回答⑥结果;根据催化剂的定义和特点回答⑦现象;
(2)根据对比实验的探究方法回答;
(3)根据图示中的滤纸的折叠处理进行分析;
(4)根据过滤的操作“一贴、二低、三靠”进行分析.
(1)根据氧化铜对过氧化氢的分解有催化作用回答③现象;根据催化剂的定义和特点回答⑥结果;根据催化剂的定义和特点回答⑦现象;
(2)根据对比实验的探究方法回答;
(3)根据图示中的滤纸的折叠处理进行分析;
(4)根据过滤的操作“一贴、二低、三靠”进行分析.
解答:解:Ⅲ、催化剂的特点是“一变,两不变”,即反应速率变,质量和化学性质不变.
(1)氧化铜对过氧化氢的分解有催化作用,能加快其分解速率生成氧气的速率,故现象是有气泡,带火星的木条复燃;催化剂的特点是“一变,两不变”,反应前后其质量不变,所以氧化铜的质量仍为0.2g;催化剂的特点是“一变,两不变”,其中反应速率改变,这里是加快,所以现象是溶液中有气泡放出,带火星的木条复燃;
(2)为了看氧化铜是否能改变反应的速率,要通过加入氧化铜与不加氧化铜的现象进行对比,才能得出科学合理的结论,所以步骤①的目的是:与③对比检验氧化铜能否加快双氧水的分解;步骤⑦的目的是:证明氧化铜的化学性质在反应前后没有改变;
(3)A、B、C 是滤纸的正确的折叠方法,D中的滤纸,接口处出现缝隙,液体会直接的进入下面的烧杯,故选D;
(4)若在④中发现滤纸和漏斗间有气泡,可能的影响是过滤速度慢,可以用玻璃棒轻压,使滤纸紧贴漏斗内壁.
故答案为:
Ⅲ.CuO是反应的催化剂,反应前后 质量和化学性质不变;
(1)
(2)与③对比检验氧化铜能否加快双氧水的分解;证明CuO的化学性质在反应前后没有改变;
(3)D;
(4)过滤速度慢;用玻璃棒轻压(使滤纸紧贴漏斗内壁).
(1)氧化铜对过氧化氢的分解有催化作用,能加快其分解速率生成氧气的速率,故现象是有气泡,带火星的木条复燃;催化剂的特点是“一变,两不变”,反应前后其质量不变,所以氧化铜的质量仍为0.2g;催化剂的特点是“一变,两不变”,其中反应速率改变,这里是加快,所以现象是溶液中有气泡放出,带火星的木条复燃;
(2)为了看氧化铜是否能改变反应的速率,要通过加入氧化铜与不加氧化铜的现象进行对比,才能得出科学合理的结论,所以步骤①的目的是:与③对比检验氧化铜能否加快双氧水的分解;步骤⑦的目的是:证明氧化铜的化学性质在反应前后没有改变;
(3)A、B、C 是滤纸的正确的折叠方法,D中的滤纸,接口处出现缝隙,液体会直接的进入下面的烧杯,故选D;
(4)若在④中发现滤纸和漏斗间有气泡,可能的影响是过滤速度慢,可以用玻璃棒轻压,使滤纸紧贴漏斗内壁.
故答案为:
Ⅲ.CuO是反应的催化剂,反应前后 质量和化学性质不变;
(1)
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 溶液中有气泡放出 带火星的木条复燃 |
0.2g | 溶液中有气泡放出, 带火星的木条复燃 |
猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立. |
(3)D;
(4)过滤速度慢;用玻璃棒轻压(使滤纸紧贴漏斗内壁).
点评:催化剂、催化作用是初中重要基本概念之一,是考查的重点和热点,主要考查对催化剂、催化作用概念的理解,对催化效率影响因素的探究等.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
学了催化剂的知识后,某同学联想氧化铜能否对过氧化氢起催化作用呢?于是进行了以下探究,请你参与他的探究.
【猜想】
Ⅰ.氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ.氧化铜是反应的催化剂,反应前后______.
【实验】用天平称量0.2g氧化铜,取5mL5%的过氧化氢溶液于试管中,进行如下实验: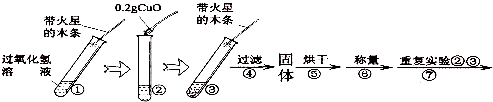
(1)填写下表空格:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 溶液中______ 带火星的木条复燃. | ______ | 溶液中有气泡放出, ______ | 猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立. |
(3)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是______(填序号).

(4)若在④中发现滤纸和漏斗间有气泡,可能的影响是______,处理的方法是______.
学了催化剂的知识后,某同学联想氧化铜能否对过氧化氢起催化作用呢?于是进行了以下探究,请你参与他的探究.
【猜想】
Ⅰ.氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ.氧化铜是反应的催化剂,反应前后______.
【实验】用天平称量0.2g氧化铜,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
(1)填写下表空格:
(2)步骤①的目的是______步骤⑦的目的是______.
(3)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是______(填序号).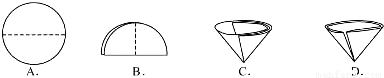
(4)若在④中发现滤纸和漏斗间有气泡,可能的影响是______,处理的方法是______.
【猜想】
Ⅰ.氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ.氧化铜是反应的催化剂,反应前后______.
【实验】用天平称量0.2g氧化铜,取5mL5%的过氧化氢溶液于试管中,进行如下实验:

(1)填写下表空格:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 溶液中______ 带火星的木条复燃. | ______ | 溶液中有气泡放出, ______ | 猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立. |
(3)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是______(填序号).
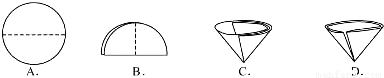
(4)若在④中发现滤纸和漏斗间有气泡,可能的影响是______,处理的方法是______.
学了催化剂的知识后,某同学联想氧化铜能否对过氧化氢起催化作用呢?于是进行了以下探究,请你参与他的探究.
【猜想】
Ⅰ.氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ.氧化铜是反应的催化剂,反应前后______.
【实验】用天平称量0.2g氧化铜,取5mL5%的过氧化氢溶液于试管中,进行如下实验: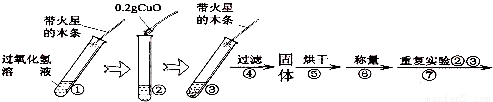
(1)填写下表空格:
(2)步骤①的目的是______步骤⑦的目的是______.
(3)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是______(填序号).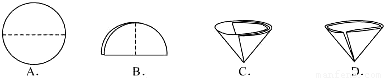
(4)若在④中发现滤纸和漏斗间有气泡,可能的影响是______,处理的方法是______.
【猜想】
Ⅰ.氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ.氧化铜是反应的催化剂,反应前后______.
【实验】用天平称量0.2g氧化铜,取5mL5%的过氧化氢溶液于试管中,进行如下实验:

(1)填写下表空格:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
| 溶液中______ 带火星的木条复燃. | ______ | 溶液中有气泡放出, ______ | 猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立. |
(3)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是______(填序号).
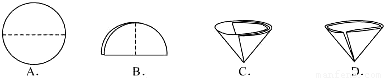
(4)若在④中发现滤纸和漏斗间有气泡,可能的影响是______,处理的方法是______.