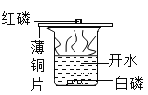
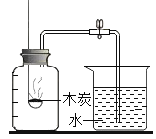
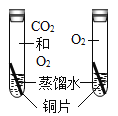
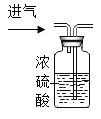
题目内容
【题目】某锥形瓶盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量与滴入的氢氧化钠溶液的质量的变化关系如图所示。
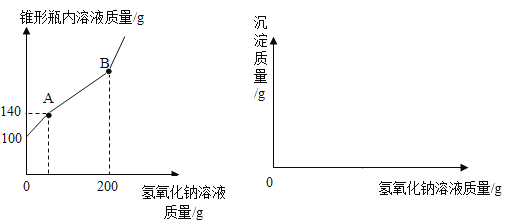
(l)反应至A点时加入氢氧化钠溶液的质量为__________;
(2)计算反应至B点时锥形瓶内所得溶液的溶质质量分数为______?(计算结果保留至0.1%)
(3)在坐标系中画出生成沉淀的质量与加入的氢氧化钠溶液质量关系的图像______。
【答案】(1)40g;(2)10.4%;(3)
【解析】
(1)所加入的氢氧化钠溶液优先与稀盐酸发生中和反应生成氯化钠和水,之后与氯化铜形成氢氧化铜沉淀。A点表示氢氧化钠与稀盐酸恰好完全反应,由图中数据可知,反应至A点时加入氢氧化钠溶液的质量为140g-100g=40g,故填:40g;
(2)设40g10%氢氧化钠溶液与盐酸反应生成的氯化钠的质量为x
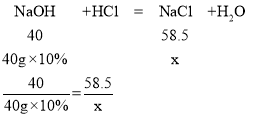
x=5.85g
根据题意,与氯化铜溶液反应的氢氧化钠溶液质量为200g-40g=160g,
设氢氧化钠溶液与氯化铜反应生成的氯化钠的质量为y,生成氢氧化铜的质量为z
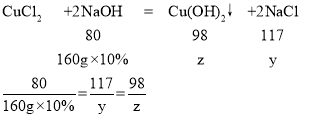
y=23.4g z=19.6g
B点时锥形瓶内所得溶液的溶质质量分数为
![]() 10.4%
10.4%
答:所得溶液的溶质质量分数为10.4%。
(3)画出加入氢氧化钠溶液质量与生成沉淀的关系图象,加入40g氢氧化钠溶液才有沉淀生成,加入氢氧化钠溶液到200g时沉淀达到最大量,质量为19.6g。得图: 。
。

 阅读快车系列答案
阅读快车系列答案【题目】在一个密闭容器中放入W、G、H、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表,关于此反应的认识不正确的是( )
物质 | W | G | H | P |
反应前质量/g | 20 | 2 | 1 | 37 |
反应后质量/g | a | 32 | 1 | 12 |
A.a=15
B.H可能是该反应的催化剂
C.若W和P的化学式量之比为1:5,则W和P的化学计量数之比为1:1
D.在反应中,G、P的质量比为5:6