题目内容
课外活动小组的同学在测定由NaCl和Na2CO3形成的固体混合物组成的,进行了以下实验:取40g固体混合物,平均分为四份放在四个容器中,然后分别加入同种稀盐酸,将生成二氧化碳气体收集后称量,实验数据见下表:
友情提示:该反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑
请分析表中数据回答并计算(第3小题要求写出计算过程)
(1)10g原固体混合物配成的溶液和足量稀盐酸反应,最多生成二氧化碳气体的质量为
(2)m为
(3)10g固体混合物中Na2CO3的质量是多少?
| 实验一 | 实验二 | 实验三 | 实验四 | |
| 原固体混合物质量 | 10g | 10g | 10g | 10g |
| 加入稀盐酸的质量 | 10g | 20g | 30g | 40g |
| 生成二氧化碳的质量 | 0.88g | m | 2.2g | 2.2g |
请分析表中数据回答并计算(第3小题要求写出计算过程)
(1)10g原固体混合物配成的溶液和足量稀盐酸反应,最多生成二氧化碳气体的质量为
2.2
2.2
g.(2)m为
1.76
1.76
g.(3)10g固体混合物中Na2CO3的质量是多少?
分析:(1)依据实验三和四中生成的二氧化碳质量可以判断最多生成二氧化碳气体的质量;
(2)根据实验数据,加入10g盐酸完全反应可生成气体的质量为0.88g,加入30g盐酸溶液时仍有气体生成,可判断表中m的值;
加入盐酸至完全反应时,生成气体的质量为2.2g,根据碳酸钠与盐酸反应的化学方程式,可由生成的二氧化碳的质量计算中原固体混合物中Na2CO3的质量;
(2)根据实验数据,加入10g盐酸完全反应可生成气体的质量为0.88g,加入30g盐酸溶液时仍有气体生成,可判断表中m的值;
加入盐酸至完全反应时,生成气体的质量为2.2g,根据碳酸钠与盐酸反应的化学方程式,可由生成的二氧化碳的质量计算中原固体混合物中Na2CO3的质量;
解答:解:(1)由于加入30g或40g盐酸生成的二氧化碳质量均为2.2g,所以可以判断最多生成二氧化碳气体的质量为2.2g;
(2)根据实验数据,加入10g盐酸完全反应可生成气体的质量为0.88g,加入30g盐酸溶液时仍有气体生成,可判断表中m的值为0.88g×2=1.76g;
(3)解:设10g固体混合物中Na2CO3的质量是x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 2.2g
=
x=5.3g
故答案为:(1)2.2;(2)1.76;(3)10g固体混合物中Na2CO3的质量是5.3g.
(2)根据实验数据,加入10g盐酸完全反应可生成气体的质量为0.88g,加入30g盐酸溶液时仍有气体生成,可判断表中m的值为0.88g×2=1.76g;
(3)解:设10g固体混合物中Na2CO3的质量是x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 2.2g
| 106 |
| x |
| 44 |
| 2.2g |
x=5.3g
故答案为:(1)2.2;(2)1.76;(3)10g固体混合物中Na2CO3的质量是5.3g.
点评:本题主要考查学生对数据分析和处理的能力,熟悉完全反应及不完全反应的概念,并能据此查找数据,进行计算是解题的关键.

练习册系列答案
相关题目
课外活动小组的同学在测定由NaCl和Na2CO3形成的固体混合物组成时,进行了以下实验:取40g固体混合物配成溶液,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表:
请分析表中数据回答并计算.
(1)m= g.
(2)原固体混合物中Na2CO3的质量分数是多少? .
| 实验一 | 实验二 | 实验三 | 实验四 | |
| 原固体混合物质量 | 10g | 10g | 10g | 10g |
| 加入CaCl2溶液质量 | 10g | 20g | 30g | 40g |
| 生成的沉淀的质量 | 2g | m | 5g | 5g |
(1)m=
(2)原固体混合物中Na2CO3的质量分数是多少?
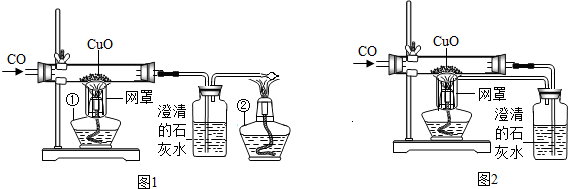
 某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分Fe2O3)炼铁的主要反应原理.他们设计的实验装置,如图:
某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分Fe2O3)炼铁的主要反应原理.他们设计的实验装置,如图: