题目内容
课外活动小组的同学在测定由NaCl和Na2CO3形成的固体混合物组成时,进行了以下实验:取40g固体混合物配成溶液,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表:| 实验一 | 实验二 | 实验三 | 实验四 | |
| 原固体混合物质量 | 10g | 10g | 10g | 10g |
| 加入CaCl2溶液质量 | 10g | 20g | 30g | 40g |
| 生成的沉淀的质量 | 2g | m | 5g | 5g |
(1)m=
(2)原固体混合物中Na2CO3的质量分数是多少?
分析:(1)根据实验数据,加入10gCaCl2溶液完全反应可生成沉淀质量为2g,加入30gCaCl2溶液时仍有沉淀生成,可判断表中m的值;
(2)加入氯化钙溶液至完全反应时,生成沉淀质量为5g,根据碳酸钠与氯化钙反应的化学方程式,可由生成沉淀碳酸钙的质量计算中原固体混合物中Na2CO3的质量,即可求得原固体混合物中Na2CO3的质量分数.
(2)加入氯化钙溶液至完全反应时,生成沉淀质量为5g,根据碳酸钠与氯化钙反应的化学方程式,可由生成沉淀碳酸钙的质量计算中原固体混合物中Na2CO3的质量,即可求得原固体混合物中Na2CO3的质量分数.
解答:解:
(1)分析实验数据可知,每加入10g氯化钙溶液可生成2g沉淀,因此加入20g氯化钙溶液时,得到沉淀质量m=2g×
=4g
故答案为:4;
(2)设10g原固体混合物中Na2CO3质量为x
CaCl2+Na2CO3═CaCO3↓+2NaCl
106 100
x 5g
=
x=5.3g
固体混合物中Na2CO3的质量分数是:
×100%=53%
答:原混合物中碳酸钠的质量分数是53%.
(1)分析实验数据可知,每加入10g氯化钙溶液可生成2g沉淀,因此加入20g氯化钙溶液时,得到沉淀质量m=2g×
| 20g |
| 10g |
故答案为:4;
(2)设10g原固体混合物中Na2CO3质量为x
CaCl2+Na2CO3═CaCO3↓+2NaCl
106 100
x 5g
| 106 |
| x |
| 100 |
| 5g |
固体混合物中Na2CO3的质量分数是:
| 5.3g |
| 10g |
答:原混合物中碳酸钠的质量分数是53%.
点评:根据实验数据表中“加入CaCl2溶液质量”与“生成的沉淀的质量”的关系,分析反应进行情况,考查分析实验数据解决问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
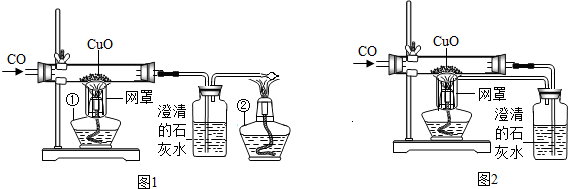
 某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分Fe2O3)炼铁的主要反应原理.他们设计的实验装置,如图:
某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分Fe2O3)炼铁的主要反应原理.他们设计的实验装置,如图: