题目内容
3月22日是“世界水日”.关于水的知识,请回答下列问题:
(1)下列净水方法中,生产自来水使用的方法有(填字母序号) ;
A.沉淀 B.过滤 C.煮沸 D.蒸馏 E.吸附
(2)实验室常用过滤的方法对液体进行提纯,在此操作中需要用到的玻璃仪器有:玻璃棒、烧杯、 (填仪器名称);生活中常用 的方法将硬水软化.
(3)有关水的组成和结构的叙述中,正确的是(填字母序号) ;
A.水是由水分子构成的 B.水分子的相对分子质量是18g
C.水中氢、氧元素的质量比为2:1 D.水分子是由氢原子和氧原子构成的
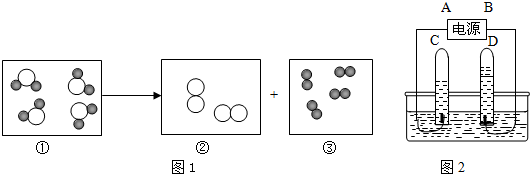
(4)下列图1示意图①~③中,“ ”表示氢原子,“
”表示氢原子,“ ”表示氧原子.表示化合物的是(填序号) ,③所代表的物质是图中 试管 (填字母) 中产生的气体,图2中A是电源的 (填“正”或“负”) 极.
”表示氧原子.表示化合物的是(填序号) ,③所代表的物质是图中 试管 (填字母) 中产生的气体,图2中A是电源的 (填“正”或“负”) 极.
(5)在TiO2作催化剂和光照条件下,水能分解成氢气和氧气,写出该反应的化学方程式 .

(1)下列净水方法中,生产自来水使用的方法有(填字母序号)
A.沉淀 B.过滤 C.煮沸 D.蒸馏 E.吸附
(2)实验室常用过滤的方法对液体进行提纯,在此操作中需要用到的玻璃仪器有:玻璃棒、烧杯、
(3)有关水的组成和结构的叙述中,正确的是(填字母序号)
A.水是由水分子构成的 B.水分子的相对分子质量是18g
C.水中氢、氧元素的质量比为2:1 D.水分子是由氢原子和氧原子构成的
(4)下列图1示意图①~③中,“
 ”表示氢原子,“
”表示氢原子,“ ”表示氧原子.表示化合物的是(填序号)
”表示氧原子.表示化合物的是(填序号)(5)在TiO2作催化剂和光照条件下,水能分解成氢气和氧气,写出该反应的化学方程式
分析:(1)根据常用净水方法回答;
(2)根据过滤所用仪器分析;生活中常用煮沸的方法将硬水中的钙、镁离子沉淀下来,达到软化水的目的;
(3)根据水的构成、组成,及相对分子质量和元素的质量比的相关知识分析解答;
(4)依据化合物分子中含有多种原子,电解水实验“负氢正氧、氢多氧少”进行回答;
(5)依据反应物、生成物、反应条件书写方程式.
(2)根据过滤所用仪器分析;生活中常用煮沸的方法将硬水中的钙、镁离子沉淀下来,达到软化水的目的;
(3)根据水的构成、组成,及相对分子质量和元素的质量比的相关知识分析解答;
(4)依据化合物分子中含有多种原子,电解水实验“负氢正氧、氢多氧少”进行回答;
(5)依据反应物、生成物、反应条件书写方程式.
解答:解:(1)自来水厂生产自来水时,使用的净水方法有沉淀、过滤、吸附;
(2)过滤需要的玻璃仪器有:烧杯、漏斗、玻璃棒;生活中常用煮沸的方法将硬水中的钙、镁离子沉淀下来,达到软化水的目的;
(3)A、水是由水分子构成的,正确;
B、水分子的相对分子质量是:2+16=18,单位是1,省略不写,故错误;
C、水中氢、氧元素的质量比为1×2:16=1:8,而不是2:1,故错误;
D、水分子是由氢原子和氧原子构成,正确;
(4)化合物是纯净物,所以化合物中只有一种分子,且分子中含有多种原子,分析图示中分子的情况可知构成化合物分子的是图①;③所代表的物质是由分子构成,是每个分子由两个氢原子构成的氢分子,氢分子构成氢气,氢气多,大约是氧气体积的2倍,是在负极得到的;
(5)在TiO2作催化剂和光照条件下,水能分解成氢气和氧气,反应的化学方程式是:2H2O
2H2↑+O2↑;
故答案为:
(1)ABE;(2)漏斗;煮沸;(3)AD;(4)①;C;负极;(5)2H2O
2H2↑+O2↑.
(2)过滤需要的玻璃仪器有:烧杯、漏斗、玻璃棒;生活中常用煮沸的方法将硬水中的钙、镁离子沉淀下来,达到软化水的目的;
(3)A、水是由水分子构成的,正确;
B、水分子的相对分子质量是:2+16=18,单位是1,省略不写,故错误;
C、水中氢、氧元素的质量比为1×2:16=1:8,而不是2:1,故错误;
D、水分子是由氢原子和氧原子构成,正确;
(4)化合物是纯净物,所以化合物中只有一种分子,且分子中含有多种原子,分析图示中分子的情况可知构成化合物分子的是图①;③所代表的物质是由分子构成,是每个分子由两个氢原子构成的氢分子,氢分子构成氢气,氢气多,大约是氧气体积的2倍,是在负极得到的;
(5)在TiO2作催化剂和光照条件下,水能分解成氢气和氧气,反应的化学方程式是:2H2O
| ||
| 光照 |
故答案为:
(1)ABE;(2)漏斗;煮沸;(3)AD;(4)①;C;负极;(5)2H2O
| ||
| 光照 |
点评:本题考查知识较为综合,考查了水的净化、水的软化方法、水的电解等知识,掌握基础知识并结合题意逐一分析即可.

练习册系列答案
相关题目

