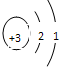题目内容
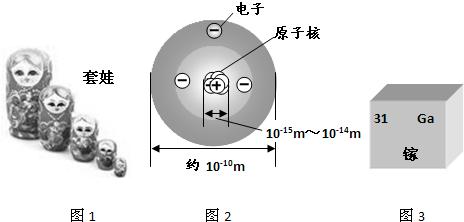
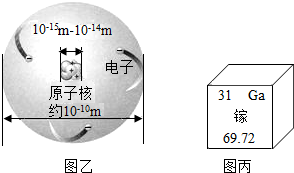
 如图是锂原子的构成示意图,根据图示信息回答下列问题:
如图是锂原子的构成示意图,根据图示信息回答下列问题:(1)锂原子的结构示意图为
D
D
(填字母).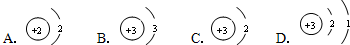
(2)锂元素与氧元素形成的化合物的化学式为
Li2O
Li2O
.(3)下列对原子构成的理解错误的是
C
C
(填字母).A.原子整体不显电性 B.原子核比原子小得多
C.原子核是不可分割的实心球体 D.原子质量主要集中在原子核上
(4)根据粒子结构示意图的共同特征,把
 三种微粒归为一类,下列微粒中可以归入此类的是
三种微粒归为一类,下列微粒中可以归入此类的是C
C
(填字母).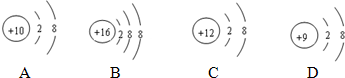
分析:在原子中,核电荷数=质子数=原子序数,其结构可用原子结构示意图表示,原子核外电子是分层排布的,核外第一电子层上最多有2个电子,第二电子层上最多排8个电子,最外电子层上最多容纳8个电子.熟知原子的构成,原子由带电的原子核和核外电子构成,原子核又是由带电的质子和不带电的中子构成,原子的质量主要集中在原子核上.即,原子的质量≈原子核的质量=质子质量+中子质量.
解答:解:(1)由锂原子的构成示意图可知原子核内有3个质子,根据原子结构核外电子的排布规律,锂原子核外共3个电子,最内层最多2个,剩余1个排在第二电子层上,所以应选D.
(2)锂原子最外层上有一个电子,易失去一个电子成为锂离子,化合价为+1价,氧元素化合价为-2价,级成化合物的化学式为Li2O;
(3)原子由带正电的原子核和核外带负电的电子构成,原子原子核所带正电和核外电子所带负电相等,原子不显电性,原子核又是由带电的质子和不带电的中子构成,原子的质量主要集中在原子核上.原子核比原子小得多,因此原子里有很大的空间,电子就在这个空间中作高速运动.故C错误,所以答案为:C.
(4)上述粒子结构示意图的共同特征是都失去电了使次外层达到8个电子,成为阳离子,故选C
故答案为:(1)D;(2)Li2O;(3)C;(4)C
(2)锂原子最外层上有一个电子,易失去一个电子成为锂离子,化合价为+1价,氧元素化合价为-2价,级成化合物的化学式为Li2O;
(3)原子由带正电的原子核和核外带负电的电子构成,原子原子核所带正电和核外电子所带负电相等,原子不显电性,原子核又是由带电的质子和不带电的中子构成,原子的质量主要集中在原子核上.原子核比原子小得多,因此原子里有很大的空间,电子就在这个空间中作高速运动.故C错误,所以答案为:C.
(4)上述粒子结构示意图的共同特征是都失去电了使次外层达到8个电子,成为阳离子,故选C
故答案为:(1)D;(2)Li2O;(3)C;(4)C
点评:本题考查原子构成,注重基础,学习中应注意对原子构成的理解和一些规律知识的掌握和运用

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
试依据核电荷数为1-18的元素的原子结构示意图,回答下列问题:
 氢(H) 氢(H) | 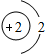 氦(He) 氦(He) | ||||||
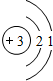 锂(Li) 锂(Li) | 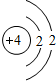 铍(Be) 铍(Be) | 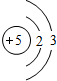 硼(B) 硼(B) | 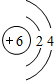 碳(C) 碳(C) | 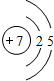 氮(N) 氮(N) |  氧(O) 氧(O) |  氟(F) 氟(F) | 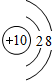 氖(Ne) 氖(Ne) |
 钠(Na) |  镁(Mg) |  铝(Al) |  硅(Si) 硅(Si) |  磷(P) 磷(P) | 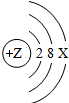 硫(S) 硫(S) | 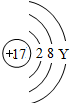 氯(Cl) 氯(Cl) |  氩(Ar) 氩(Ar) |
①从原子结构示意图分析,11~18号元素排在一行的依据是______;
②在此周期中,从左到右,原子结构变化情况是______;
③在此周期中,从左到右,元素原子得失电子的变化情况是______;
④在此周期中,从左到右,元素种类的变化情况是______.
(2)上图中硫元素的核电荷数Z=______;氯元素的最外层电子数Y=______(填数值).
(3)核电荷数为12的元素的原子失去两个电子后,形成的粒子的符号是______.
它的核外电子排布与______元素的原子核外电子排布相同.
(4)上图的排列具有一定的规律,如:同一行中,从左到右元素的核电荷数依次增加.你还能找到哪些规律?试写出其中一个:______.
(5)钙元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图
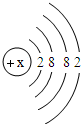 所示,则该元素的原子序数为______,该元素属于______(填“金属”或“非金属”)元素,该元素在化合物中的常见化合价为______.该元素在上表中位于______(选A、B、C)处.
所示,则该元素的原子序数为______,该元素属于______(填“金属”或“非金属”)元素,该元素在化合物中的常见化合价为______.该元素在上表中位于______(选A、B、C)处.(6)月球上的3He(3表示相对原子质量)蕴藏量巨大,探月的目标之一是探测核聚变燃料3He的分布.地球上的氦元素主要以4He形式存在.从原子的构成来看,3He、4He两种原子的电子数______(填相同或不同),化学性质______.
试依据核电荷数为1-18的元素的原子结构示意图,回答下列问题:
(1)现以第三周期为例,回答下列问题
①从原子结构示意图分析,此周期排列的依据是______;
②在此周期中,原子结构变化情况是______;
③在此周期中,元素化学性质的变化情况是______;
④在此周期中,元素种类的变化情况是______.
(2)上图中硫元素的核电荷数z=______;氯元素的最外层电子数Y=______(填数值),则与氯元素化学性质相似的元素是______.
(3)核电荷数为12的元素的原子失去两个电子后,形成的粒子的符号是______,它的核外电子排布与______元素的原子核外电子排布相同.
(4)上图的排列具有一定的规律,如:同一行中,从左到右元素的核电荷数依次增加.你还能找到哪些规律?试写出其中一个:______.
(5)钙元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图所示,则该元素的原子序数为______,该元素属于______(填“金属”或“非金属”)元素,该元素在化合物中的常见化合价为______. 元素在上表中位于______(选A、B、C)处.
元素在上表中位于______(选A、B、C)处.
(6)月球上的3He(3表示相对原子质量)蕴藏量巨大,探月的目标之一是探测核聚变燃料3He的分布.地球上的氦元素主要以4He形式存在.从原子的构成来看,3He、4He两种原子的中子数______(填相同或不同),化学性质______.
 氢(H) 氢(H) |  氦(He) 氦(He) | ||||||
 锂( Li) 锂( Li) | 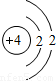 铍(Be) 铍(Be) |  硼(B) 硼(B) |  碳(C) 碳(C) |  氮(N) 氮(N) |  氧(O) 氧(O) |  氟(F) 氟(F) |  氖(Ne) 氖(Ne) |
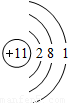 钠(Na) 钠(Na) |  镁(Mg) 镁(Mg) |  铝(Al) 铝(Al) | 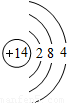 硅(Si) 硅(Si) |  磷(P) 磷(P) | 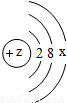 硫(S) 硫(S) |  氯(Cl) 氯(Cl) |  氩(Ar) 氩(Ar) |
| A | B | C | |||||
①从原子结构示意图分析,此周期排列的依据是______;
②在此周期中,原子结构变化情况是______;
③在此周期中,元素化学性质的变化情况是______;
④在此周期中,元素种类的变化情况是______.
(2)上图中硫元素的核电荷数z=______;氯元素的最外层电子数Y=______(填数值),则与氯元素化学性质相似的元素是______.
(3)核电荷数为12的元素的原子失去两个电子后,形成的粒子的符号是______,它的核外电子排布与______元素的原子核外电子排布相同.
(4)上图的排列具有一定的规律,如:同一行中,从左到右元素的核电荷数依次增加.你还能找到哪些规律?试写出其中一个:______.
(5)钙元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图所示,则该元素的原子序数为______,该元素属于______(填“金属”或“非金属”)元素,该元素在化合物中的常见化合价为______.
 元素在上表中位于______(选A、B、C)处.
元素在上表中位于______(选A、B、C)处.(6)月球上的3He(3表示相对原子质量)蕴藏量巨大,探月的目标之一是探测核聚变燃料3He的分布.地球上的氦元素主要以4He形式存在.从原子的构成来看,3He、4He两种原子的中子数______(填相同或不同),化学性质______.
试依据核电荷数为1-18的元素的原子结构示意图,回答下列问题:
(1)现以第三周期(第11-18号元素)为例,仔细观察,认真思考后回答下列问题:
①从原子结构示意图分析,11~18号元素排在一行的依据是 ;
②在此周期中,从左到右,原子结构变化情况是 ;
③在此周期中,从左到右,元素原子得失电子的变化情况是 ;
④在此周期中,从左到右,元素种类的变化情况是 .
(2)上图中硫元素的核电荷数Z= ;氯元素的最外层电子数Y= (填数值).
(3)核电荷数为12的元素的原子失去两个电子后,形成的粒子的符号是 .
它的核外电子排布与 元素的原子核外电子排布相同.
(4)上图的排列具有一定的规律,如:同一行中,从左到右元素的核电荷数依次增加.你还能找到哪些规律?试写出其中一个: .
(5)钙元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图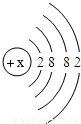 所示,则该元素的原子序数为 ,该元素属于 (填“金属”或“非金属”)元素,该元素在化合物中的常见化合价为 .该元素在上表中位于 (选A、B、C)处.
所示,则该元素的原子序数为 ,该元素属于 (填“金属”或“非金属”)元素,该元素在化合物中的常见化合价为 .该元素在上表中位于 (选A、B、C)处.
(6)月球上的3He(3表示相对原子质量)蕴藏量巨大,探月的目标之一是探测核聚变燃料3He的分布.地球上的氦元素主要以4He形式存在.从原子的构成来看,3He、4He两种原子的电子数 (填相同或不同),化学性质 .
 氢(H) 氢(H) | 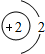 氦(He) 氦(He) | ||||||
 锂(Li) 锂(Li) |  铍(Be) 铍(Be) |  硼(B) 硼(B) |  碳(C) 碳(C) |  氮(N) 氮(N) |  氧(O) 氧(O) | 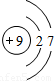 氟(F) 氟(F) |  氖(Ne) 氖(Ne) |
 钠(Na) |  镁(Mg) |  铝(Al) | 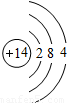 硅(Si) 硅(Si) |  磷(P) 磷(P) |  硫(S) 硫(S) |  氯(Cl) 氯(Cl) |  氩(Ar) 氩(Ar) |
①从原子结构示意图分析,11~18号元素排在一行的依据是 ;
②在此周期中,从左到右,原子结构变化情况是 ;
③在此周期中,从左到右,元素原子得失电子的变化情况是 ;
④在此周期中,从左到右,元素种类的变化情况是 .
(2)上图中硫元素的核电荷数Z= ;氯元素的最外层电子数Y= (填数值).
(3)核电荷数为12的元素的原子失去两个电子后,形成的粒子的符号是 .
它的核外电子排布与 元素的原子核外电子排布相同.
(4)上图的排列具有一定的规律,如:同一行中,从左到右元素的核电荷数依次增加.你还能找到哪些规律?试写出其中一个: .
(5)钙元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图
 所示,则该元素的原子序数为 ,该元素属于 (填“金属”或“非金属”)元素,该元素在化合物中的常见化合价为 .该元素在上表中位于 (选A、B、C)处.
所示,则该元素的原子序数为 ,该元素属于 (填“金属”或“非金属”)元素,该元素在化合物中的常见化合价为 .该元素在上表中位于 (选A、B、C)处.(6)月球上的3He(3表示相对原子质量)蕴藏量巨大,探月的目标之一是探测核聚变燃料3He的分布.地球上的氦元素主要以4He形式存在.从原子的构成来看,3He、4He两种原子的电子数 (填相同或不同),化学性质 .