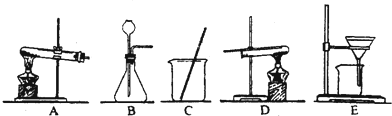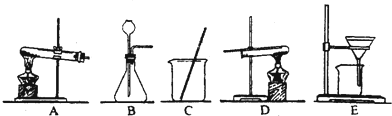题目内容
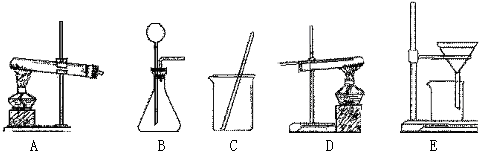
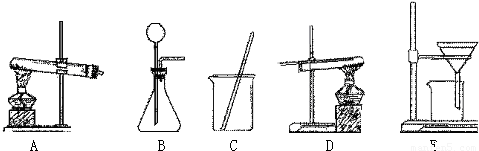
采用两种方法制取铜,现有铁、氧化铜、稀硫酸三种物质及如图所示实验装置供选择.(1)第一种方法的实验过程中有蓝色溶液产生,应选用如图所示装置中的(填序号) .
(2)第二种方法应选用如图所示装置中的 .
(3)在第一种方法制取的铜中,对于可能存在的杂质,可以加 除去;在第二种方法制取的铜中,可能存在的杂质是 .
(4)若用这两种方法制得的铜的质量相等,下列叙述符合实际试验结果的是 .
①消耗氧化铜的质量相等 ②消耗铁的质量相等
③消耗硫酸的质量相等 ④生成硫酸亚铁的质量不相等
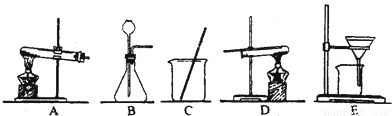
【答案】分析:根据铁、氧化铜、稀硫酸三种物质之间的反应规律分析解答,氧化铜能与稀硫酸反应生成硫酸铜,铁能置换硫酸铜溶液中的铜;铁能与稀硫酸反应生成氢气,氢气能置换氧化铜中的铜.利用两种途径的过程,书写相应的化学方程式,根据反应的物质之间量的关系进行判断,从氢气还原氧化铜,氢气必须过量,所以要使用更多锌更多硫酸,制取相同质量的铜,铜只来源于氧化铜,所以消耗的氧化铜质量相等,利用这些关系解决此题.
解答:解:(1)用铁、氧化铜、稀硫酸三种物质制取铜,实验过程中有蓝色溶液产生,因此方法是将氧化铜与硫酸反应生成硫酸铜,然后将铁与硫酸铜反应置换出铜,采用过滤法即可得到铜.故选用的装置应为CE;
(2)第二种方法是铁与稀硫酸反应生成氢气,氢气置换氧化铜中的铜.因此用到的装置还有B,固液常温下制取气体的装置,然后用氢气还原氧化铜,用到的装置是D
(3)在第一种方法中铁与硫酸铜反应时由于生成的铜覆盖在铁的表面,制取的铜中可能会含有铁,铁与硫酸反应而铜不与硫酸反应,因此可加入硫酸除去铁.第二种方法中氢气还原氧化铜时氧化铜没完全反应,生成的铜中会混有氧化铜.
(4)因为整个制备过程中,所有Cu元素都能形成单质Cu,而都来自CuO,没有损失,所以①②氧化铜质量相同.
①Fe+H2SO4=FeSO4+H2↑,H2+CuO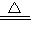 H2O+Cu 生成1份Cu需要1份CuO和1份H2SO4和1份Fe
H2O+Cu 生成1份Cu需要1份CuO和1份H2SO4和1份Fe
②CuO+H2SO4=CuSO4+H2O,CuSO4+Fe=Cu+FeSO4 生成1份Cu需要1份CuO和1份H2SO4和1份Fe
看上去都是相同的.特别注意用H2还原氧化铜的时候,需要先通H2然后加热,以将空气从玻璃管中排出.如果不排出,会引起爆炸,所以H2的量要多一些.自然H2SO4和铁的量也要多一些,同时生成的硫酸亚铁质量可能不同.
故选①④.
故答案为:(1)CE (2)BD (3)稀硫酸 氧化铜(4)①④
点评:明确单质、氧化物、酸碱盐之间的反应规律是解答制备物质题的关健
解答:解:(1)用铁、氧化铜、稀硫酸三种物质制取铜,实验过程中有蓝色溶液产生,因此方法是将氧化铜与硫酸反应生成硫酸铜,然后将铁与硫酸铜反应置换出铜,采用过滤法即可得到铜.故选用的装置应为CE;
(2)第二种方法是铁与稀硫酸反应生成氢气,氢气置换氧化铜中的铜.因此用到的装置还有B,固液常温下制取气体的装置,然后用氢气还原氧化铜,用到的装置是D
(3)在第一种方法中铁与硫酸铜反应时由于生成的铜覆盖在铁的表面,制取的铜中可能会含有铁,铁与硫酸反应而铜不与硫酸反应,因此可加入硫酸除去铁.第二种方法中氢气还原氧化铜时氧化铜没完全反应,生成的铜中会混有氧化铜.
(4)因为整个制备过程中,所有Cu元素都能形成单质Cu,而都来自CuO,没有损失,所以①②氧化铜质量相同.
①Fe+H2SO4=FeSO4+H2↑,H2+CuO
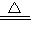 H2O+Cu 生成1份Cu需要1份CuO和1份H2SO4和1份Fe
H2O+Cu 生成1份Cu需要1份CuO和1份H2SO4和1份Fe②CuO+H2SO4=CuSO4+H2O,CuSO4+Fe=Cu+FeSO4 生成1份Cu需要1份CuO和1份H2SO4和1份Fe
看上去都是相同的.特别注意用H2还原氧化铜的时候,需要先通H2然后加热,以将空气从玻璃管中排出.如果不排出,会引起爆炸,所以H2的量要多一些.自然H2SO4和铁的量也要多一些,同时生成的硫酸亚铁质量可能不同.
故选①④.
故答案为:(1)CE (2)BD (3)稀硫酸 氧化铜(4)①④
点评:明确单质、氧化物、酸碱盐之间的反应规律是解答制备物质题的关健

练习册系列答案
相关题目