题目内容
【题目】食盐是一种重要的化工原料。请回答下列问题。
(1)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
![]()
①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和________。
②在蒸发过程中,待________________时,停止加热,利用余热将滤液蒸干。
(2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
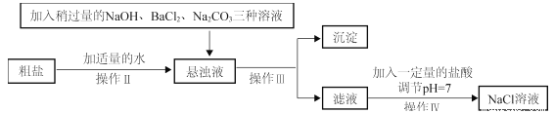
①加入稍过量Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是________________________(用化学方程式表示)。
②通过操作Ⅲ所得滤液中的溶质有________________。
【答案】 漏斗 蒸发皿中出现较多固体 BaCl2+Na2CO3===BaCO3↓+2NaCl Na2CO3、NaCl、NaOH
【解析】分析:(1)①从过滤操作进行分析;
②从蒸发操作注意事项进行分析;
(2)①从复分解反应的必要条件进行分析,碳酸钠与![]() 、
、![]() 都能反应。
都能反应。![]()
②从![]() 、
、![]() 的用量以及
的用量以及![]() 和
和![]() 的反应的生成物进行分析。
的反应的生成物进行分析。
解答:(1)①操作Ⅰ是过滤,过滤所需要的仪器有玻璃棒、烧杯和漏斗;
②在蒸发过程中,待蒸发皿出现较多固体时停止加热,利用余热将滤液蒸干;
(2)①碳酸钠可以和氯化钙或氯化钡反应生成沉淀,从而除去粗盐中的氯化钙和氯化钡,碳酸钠和氯化钡反应的方程式为![]() ;
;
②粗盐中的杂质氯化镁与氢氧化钠反应生成氯化钠和氢氧化镁沉淀,与碳酸钠反应生成氯化钠和碳酸镁沉淀,杂质中的氯化钙与碳酸钠反应生成氯化钠和碳酸钙沉淀,杂质中的硫酸钠与氯化钡反应生成硫酸钡沉淀和氯化钠,反应后经过过滤除去沉淀,剩余的是大量的氯化钠和少量的碳酸钠和氢氧化钠。

【题目】某化学兴趣小组的学生,发现金属R不在初中学到的金属活动性顺序表中,该小组为了了解R与常见金属铝、铜的金属活动性顺序,进行如下探究活动:
【作出猜想】他们考虑到铝的活动性比铜强,对三种金属的活动性顺序作出如下猜想:
猜想一:Al>Cu>R,猜想二:________________,猜想三:R>Al>Cu。
【查阅资料】R是一种银白色的金属,RSO4溶液呈蓝色;常温下铝的表面会形成一层致密的氧化膜;硫酸铝、氯化铝、硝酸铝的溶液均为无色。
【实验探究】为了探究哪一种猜想成立,甲、乙、丙三位同学分别针对猜想一、猜想二、猜想三设计实验方案并展开实验探究。
猜想 | 主要操作 | 主要现象 | 实验结论 |
一 | 打磨R丝,并将其插入到硫酸铜溶液中 | R丝表面覆盖了一层红色的物质 | 猜想一________(“成立”或“不成立”) |
二 | 打磨粗细相同的R丝、铝丝、铜丝,分别将它们插入到体积相同、溶质质量分数也相同的稀硫酸中 | ①R丝表面产生气泡缓慢,溶液由无色逐渐变成蓝色 ②铝丝表面产生气泡较快 ③铜丝表面没有气泡产生 | 猜想二成立 |
三 | 把铝丝插入RSO4溶液中 | ________________ | 猜想三成立 |
【交流反思】究竟哪种猜想成立?三位同学经讨论交流,发现丙同学在实验前没有打磨铝丝,这可能会导致实验结论错误。于是他们先打磨铝丝,再将其插入到RSO4溶液中,一段时间后,溶液的颜色由________色变为________色;进而确认猜想三不成立,猜想二成立。写出Al与稀硫酸反应的化学方程式:____________________________。
【归纳总结】探究结束后,他们总结得出:通过金属与酸反应或金属与盐溶液反应可以比较金属活动性强弱。



