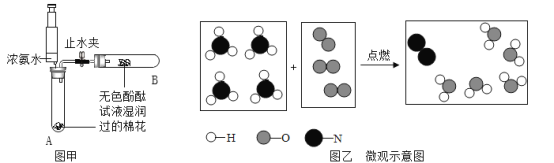
题目内容
【题目】高锰酸钾在生产、生活中有广泛应用。实验小组对高锰酸钾的某些性质进行研究。
Ⅰ.不稳定性

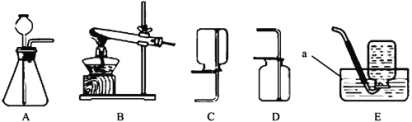
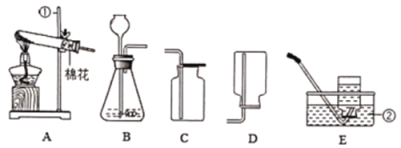
(1)如图所示进行实验,受热分解的文字表达式为___________________________
(2)用向上排空气法收集O2的原因是_______________________________________
(3)用排水法收集O2时,实验结束后先熄灭酒精灯,导致水槽中水倒流进入了导气管。可采取的补救措施是_____________________________________________(说出一种)
Ⅱ.腐蚀性:“对比试验”是科学探究常用的方法
(查阅资料)KMnO4溶液有腐蚀性
(进行实验)在室温下,将铜片分别浸泡在4种浸泡相同时间,现象如下表:
编号 | ① | ② | ③ | ④ | |
实验 |
25mL 0.1% KMnO4溶液 |
25mL 0.1%KMnO4溶 液+10滴浓硫酸 |
25mL蒸馏水+ 10滴浓硫酸 |
25mL 1% KMnO4溶 液+10滴浓硫酸 | |
铜片 质量/g | 实验前 | 0.54 | 0.54 | 0.54 | 0.54 |
18小时后 | 0.54 | 0.52 | X | 0.43 | |
(解释与结论)
(4)通过对比②和④,得出的结论是____________________________________
(5)实验③中,欲得出“KMnO4和硫酸共同作用对铜才有腐蚀性”的结论,X的值为_______,需要对比___(填编号)
(6)为了探究KMnO4的腐蚀性是否与温度有关,请您补充探究实验⑤_______________________
【答案】高锰酸钾![]() 锰酸钾+二氧化锰+氧气 氧气密度大于空气且不与空气反应 将导管移除试管 相同的H2SO4浓度下,高锰酸钾的浓度越高腐蚀性越强 0.54 ④ 向盛有25mL 1% KMnO4和10滴浓硫酸的烧杯中放入0.54g的铜片,加热,放置18小时后,称量铜片的质量
锰酸钾+二氧化锰+氧气 氧气密度大于空气且不与空气反应 将导管移除试管 相同的H2SO4浓度下,高锰酸钾的浓度越高腐蚀性越强 0.54 ④ 向盛有25mL 1% KMnO4和10滴浓硫酸的烧杯中放入0.54g的铜片,加热,放置18小时后,称量铜片的质量
【解析】
(1)根据高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气进行解答;
(2)根据氧气的性质进行分析解答;
(3)根据高锰酸钾制备氧气的实验注意事项进行分析解答;
(4)实验现象进行分析解答;
(5)根据对比实验原理进行分析解答;
(6)根据对比实验原理进行分析解答。
(1)高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,反应文字表达式为:高锰酸钾![]() 锰酸钾+二氧化锰+氧气;
锰酸钾+二氧化锰+氧气;
(2) 密度大于空气且不与空气中其他成分发生反应,氧气可用向上排空气法收集;
(3)用高锰酸钾制备氧气并用排水法收集,实验结束时,先熄灭酒精灯,导致水槽中的水倒流进入了导气管。可采取的补救措施是:将导管移除试管或用酒精灯重新加热、用夹子夹住胶皮管等;
(4)实验条件的变量是KMnO4的浓度,实验现象中铜片质量的变化证明Cu被腐化,腐化现象的差异证明在相同的H2SO4浓度下,高锰酸钾的浓度越高腐蚀性越强;
(5)实验③中,若欲得出“KMnO4和硫酸共同作用对铜才有腐蚀性”的结论,说明只有硫酸对铜没有腐蚀性,所以18小时后X的值,仍为5.4g;实验④中溶液成分是25mL 1% KMnO4溶液+10滴浓硫酸,实验③中溶液成分是25mL蒸馏水+10滴浓硫酸,根据对比实验原理,实验中,欲得出“KMnO4和硫酸共同作用对铜才有腐蚀性”的结论,需要与实验④对比;
(6)为了探究KMnO4的腐蚀性是否与温度有关,根据对比实验原理,探究实验可设计如下:向盛有25mL 1% KMnO4和10滴浓硫酸的烧杯中放入0.54g的铜片,加热,放置18小时后,称量铜片的质量。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】某化学课堂围绕“酸碱中和反应”进行探宄活动.
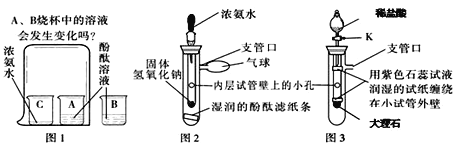
(演示实验)将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是______。
(查阋资料)CaC12溶液显中性
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
(猜想与假设)针对疑问,甲组同学猜想如下:
猜想a:只有CaC12
猜想b:有_______(填化学式)
猜想c:有CaC12和Ca(OH)2
(实验探究)为了验证猜想,乙小组进行了下列三个方案的探究。
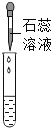
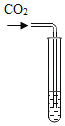
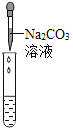
实验方案 | 滴加紫色石蕊试液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
实验现象 | 石蕊试液变蓝 | _________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
(得出结论)通过探究,同学们一致确定猜想_________(填写字母)是正确的。
(评价反思)(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因_______________。
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外.还需要考虑____________。