题目内容
市售双氧水溶液中含H2O2的质量分数为30%,密度1.1122g/cm3.分别计算(写出计算过程,结果精确到0.1):
(1)每1000mL上述双氧水溶液中,含H2O2多少克?
(2)已知H2O2在MnO2催化下,可发生下列反应: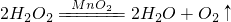 ,欲用该溶液制取96g氧气,至少需取用30%的H2O2溶液多少毫升?
,欲用该溶液制取96g氧气,至少需取用30%的H2O2溶液多少毫升?
解:(1)1000cm3=1000mL,1000cm3×1.1122g/cm3×30%=333.7g
(2)设至少需H2O2的质量为x
2H2O2 2H2O+O2↑
2H2O+O2↑
68 32
x 96g
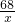 =
=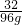 x=204g
x=204g
需取用30%的H2O2溶液的体积为:204g÷30%÷1.1122g/cm3=611.4cm3
答:每1000mL双氧水溶液中含H2O2的质量为333.7g;至少需取用30%的H2O2溶液611.4mL.
分析:(1)使用质量与体积的关系式m=ρV,把1000mL溶液转化为质量后,根据一定量溶液中溶质的质量=溶液质量×溶液中溶质的质量分数,完成溶质质量的计算;
(2)根据反应的化学方程式,由产生氧气的质量计算出所需要30%的H2O2溶液的质量,再使用质量与体积的关系式m=ρV,计算所需取用30%的H2O2溶液的体积.
点评:一定量溶液中溶质的质量=溶液质量×溶液中溶质质量分数,已知等式中任意两个意可计算出第三个量.
(2)设至少需H2O2的质量为x
2H2O2
 2H2O+O2↑
2H2O+O2↑68 32
x 96g
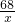 =
=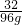 x=204g
x=204g需取用30%的H2O2溶液的体积为:204g÷30%÷1.1122g/cm3=611.4cm3
答:每1000mL双氧水溶液中含H2O2的质量为333.7g;至少需取用30%的H2O2溶液611.4mL.
分析:(1)使用质量与体积的关系式m=ρV,把1000mL溶液转化为质量后,根据一定量溶液中溶质的质量=溶液质量×溶液中溶质的质量分数,完成溶质质量的计算;
(2)根据反应的化学方程式,由产生氧气的质量计算出所需要30%的H2O2溶液的质量,再使用质量与体积的关系式m=ρV,计算所需取用30%的H2O2溶液的体积.
点评:一定量溶液中溶质的质量=溶液质量×溶液中溶质质量分数,已知等式中任意两个意可计算出第三个量.

练习册系列答案
相关题目
 实验室用过氧化氢(H2O2)溶液(俗称双氧水)制取氧气,装置如图,请回答下列问题.
实验室用过氧化氢(H2O2)溶液(俗称双氧水)制取氧气,装置如图,请回答下列问题. 实验室用过氧化氢(H2O2)溶液(俗称双氧水)制取氧气,装置如图,请回答下列问题.
实验室用过氧化氢(H2O2)溶液(俗称双氧水)制取氧气,装置如图,请回答下列问题.