题目内容
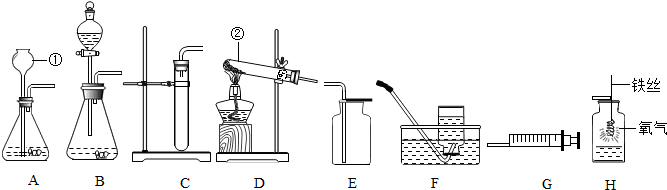
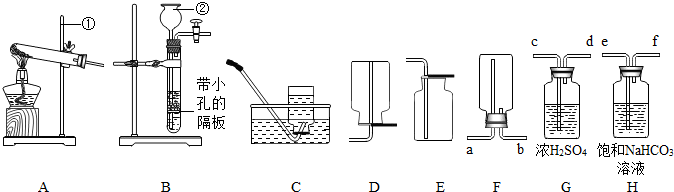
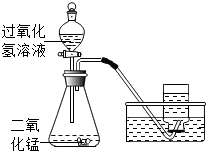
 实验室用过氧化氢(H2O2)溶液(俗称双氧水)制取氧气,装置如图,请回答下列问题.
实验室用过氧化氢(H2O2)溶液(俗称双氧水)制取氧气,装置如图,请回答下列问题.(1)写出图中有标号仪器的名称:a
试管
试管
;b集气瓶
集气瓶
.(2)写出有关反应的化学方程式:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(3)收集氧气除用向上排气法外,还可以采用
排水
排水
法.(4)H2O2中氢元素与氧元素的质量比为
1:16
1:16
.50g市售30%的双氧水中含H2O215
15
g,加水稀释成实验用的双氧水500g后,溶液中H2O2的质量分数为3%
3%
.(相对原子质量:H-1 O-16)分析:(1)根据仪器的图形和用途回答;
(2)熟记过氧化氢溶液分解制取氧气的化学反应式;
(3)根据气体的性质判断收集方法.
(4)根据物质的化学式和溶质质量分数的计算公式解答,溶液稀释前后溶质的质量不变.
(2)熟记过氧化氢溶液分解制取氧气的化学反应式;
(3)根据气体的性质判断收集方法.
(4)根据物质的化学式和溶质质量分数的计算公式解答,溶液稀释前后溶质的质量不变.
解答:解:(1)图中有标号仪器的名称为:a 试管;b 集气瓶.
(2)过氧化氢溶液在二氧化锰的催化作用下分解生成水和氧气,化学方程式是:2H2O2
2H2O+O2↑
(3)氧气的密度比空气大,不易溶于水,故收集氧气除用向上排气法外,还可以采用排水法;
(3)H2O2中氢元素与氧元素的质量比为(1×2):(16×2)=1:16.50g市售30%的双氧水中含H2O2 的质量为:50g×30%=15g,加水稀释成实验用的双氧水500g后,溶质的质量不变,溶液中H2O2的质量分数为
×100%=3%.
故答案为:(1)a 试管;b 集气瓶.
(2)2H2O2
2H2O+O2↑.
(3)排水法.
(4)1:16. 15g,3%.
(2)过氧化氢溶液在二氧化锰的催化作用下分解生成水和氧气,化学方程式是:2H2O2
| ||
(3)氧气的密度比空气大,不易溶于水,故收集氧气除用向上排气法外,还可以采用排水法;
(3)H2O2中氢元素与氧元素的质量比为(1×2):(16×2)=1:16.50g市售30%的双氧水中含H2O2 的质量为:50g×30%=15g,加水稀释成实验用的双氧水500g后,溶质的质量不变,溶液中H2O2的质量分数为
| 15g |
| 500g |
故答案为:(1)a 试管;b 集气瓶.
(2)2H2O2
| ||
(3)排水法.
(4)1:16. 15g,3%.
点评:本题考查了实验室利用过氧化氢制取氧气的反应原理、发生和收集装置的选取,明确方程式的书写原则和选择装置的依据即可正确解答.

练习册系列答案
相关题目