题目内容
已知一块废弃的合金材料由金、铜两种金属组成,为了测定各成分的含量,技术人员将合金样品磨成粉末,取6.3g该粉末在空气中加热使其充分反应,冷却后称量,样品质量增至7.7 g。试计算:
(1)该合金材料中金的质量分数。
(2)若在灼烧后样品中加入稀硫酸使其恰好完全反应,然后再用铁将溶液中的铜置换出来,理论上需要消耗铁的质量是多少克?
(1)该合金材料中金的质量分数。
(2)若在灼烧后样品中加入稀硫酸使其恰好完全反应,然后再用铁将溶液中的铜置换出来,理论上需要消耗铁的质量是多少克?
解:(1)设6.3g样品中铜的质量为x。
2Cu+O2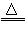 2CuO
2CuO
2×64 32
x (7.7-6.3)g
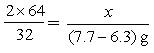
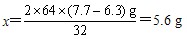
样品中金的质量分数为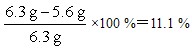
(2)设理论上需要消耗铁的质量为y。
CuO+H2SO4==CuSO4+H2O
Fe+CuSO4==FeSO4+Cu
56 64
y 5.6g
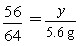
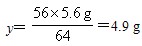
答:合金材料中金的质量分数为11.1%,理论上需要铁的质量为4.9g。
2Cu+O2
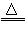 2CuO
2CuO2×64 32
x (7.7-6.3)g
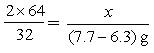
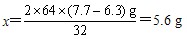
样品中金的质量分数为
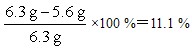
(2)设理论上需要消耗铁的质量为y。
CuO+H2SO4==CuSO4+H2O
Fe+CuSO4==FeSO4+Cu
56 64
y 5.6g
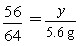
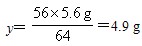
答:合金材料中金的质量分数为11.1%,理论上需要铁的质量为4.9g。

练习册系列答案
相关题目