题目内容
【题目】(8分)电石是一种重要的化工原料,极易与水反应:CaC2+2H2O=Ca(OH)2+X↑。
(1)将电石长期露置于空气中,会发生下列变化:
![]()
题干中电石与水反应后所得的气体X的化学式是_______,残渣中的主要成分是Ca(OH)2和_______ (写名称)。
(2)工业上利用电石制备某化工原料的流程如下(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):
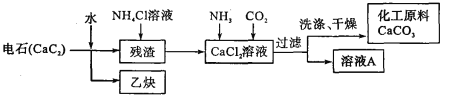
①CaCl2溶液中通人NH3、CO2两种气体,生成CaCO3的化学方程式为_______ 。
②流程中溶液A可循环使用,溶液A中的主要成分的化学式是_______。
③实验室中对过滤所得的固体进行洗涤在_______ 中进行,加洗涤剂时以浸没固体的量为宜。
(3)检验沉淀洗涤干净的方法:取最后一次洗涤液少量置于试管中滴加试剂硝酸银溶液,若观察到_______ ,则证明洗涤干净。
(4)电石应该_______保存。
【答案】(1)C2H2 碳酸钙
(2)①CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl ②NH4Cl ③过滤器
(3)无明显现象或无白色沉淀 (4)密封
【解析】
试题分析:(1)根据质量守恒定律的微观解释:在化学反应前后,原子的种类、数目都不变,结合化学反应:CaC2+2H2O=Ca(OH)2+X↑,可以推出X的化学式为C2H2;因为氢氧化钙会与空气的二氧化碳反应生成碳酸钙,故残渣中的主要成分是Ca(OH)2和 碳酸钙
(2)①CaCl2溶液中通人NH3、CO2两种气体,生成CaCO3的化学方程式为:CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl
②可循环使用的物质应是某个化学反应的生成物,又是某个化学反应的反应物,故流程中溶液A可循环使用,溶液A中的主要成分的化学式是NH4Cl
③实验室中对过滤所得的固体进行洗涤在过滤器中进行,加洗涤剂时以浸没固体的量为宜
(3)因为过滤所得的碳酸钙固体上可以粘有NH4Cl,故检验沉淀洗涤干净,实际就是检验洗涤液中是否含有NH4Cl,故方法为::取最后一次洗涤液少量置于试管中滴加试剂硝酸银溶液,若观察到无明显现象或无白色沉淀,则证明洗涤干净
(4) 根据上面的探究,电石应该密封保存



