题目内容
【题目】有一包金属粉末,可能由 Mg、Zn、Fe、Al、Ag 等金属中的一种或几种组成,取该样品 2.4g,加入 100g 稀硫酸恰好完全反应,得 0.2gH2和无色溶液。下列说法不正确的是
A. 样品中一定不含有 Ag,可能含有 Fe B. 无色溶液中溶质总质量量为 12g
C. 稀硫酸的溶质质量分数为 39.2% D. 样品可能由 Zn 和 Al 组成
【答案】D
【解析】
Mg、Zn、Fe、Al、Ag五种金属中,银不能与酸反应生成氢气;生成0.2g氢气需要各金属的质量分别为:镁2.4g、锌6.5g、铁5.6g、铝1.8g;如果只有一种金属,则样品为镁;如果样品中有多种金属,则样品中一定含铝,还有锌、铁、银中的一种或几种,才能满足2.4g金属与酸反应生成0.2g氢气。
A、由分析可知,银与铝的混合物2.4g与足量酸反应也有可能生成0.2g氢气,选项错误;
B、由于银不能与酸反应生成氢气,如果金属中含有银,则反应后溶液中溶质总质量量小于 12g,选项错误;
C、生成0.2g氢气消耗纯硫酸的质量为9.8g,所用稀硫酸的溶质质量分数为![]()
D、生成0.2g氢气需要锌6.5g、铝1.8g,所以2.4g金属与硫酸恰好反应生成0.2g氢气,该金属样品有可能是由 Zn 和 Al 组成,选项正确,故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
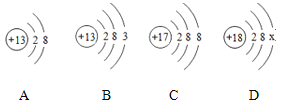
小学生10分钟应用题系列答案【题目】下表是元素周期表的一部分,则下列叙述正确的是( )
11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
A. 16号元素的离子符号是S-2
B. 氯元素的原子结构示意图是
C. 14号元素是金属元素
D. 12号元素的相对原子质量是12
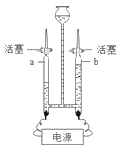
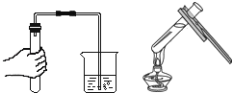
【题目】小明同学在家里的药箱中发现一瓶用来清洗伤口用的消毒液——“双氧水”,他联想到在化学课上曾用过氧化氢溶液制取过氧气,他高兴的将家中的“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验。
(第一组实验)小明欲证明该双氧水是否失效。
实验过程
①在试管中加入5 mL “双氧水”,把带火星的木条伸入试管中,发现木条未复燃;
②用酒精灯给上述试管加热,液体中有气泡产生,把带火星的木条伸入试管中,发现木条仍未复燃;
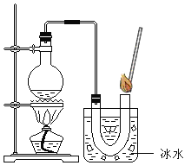
③如图装置进行操作,带火星的木条复燃,
(1)水槽中冰水所起的作用是 __________________________________;
(2)实验结论:___________________________________________________。
(第二组实验)小明想探究CuO能否起到类似MnO2的催化作用。
(3)[猜想]Ⅰ CuO不是催化剂,也不参与反应,反应前后质量和化学性质不变;
Ⅱ CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ CuO是反应的催化剂,反应前后____________________________________
[实验]用天平称量0.2gCuO,取5ml 5%过氧化氢溶液于试管中,进行实验:
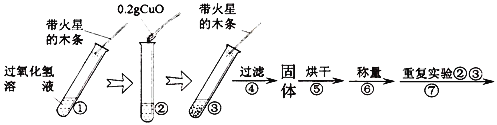
(4)填表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
_______; 带火星木条复燃 | ________ | 溶液中有气泡产生; _____________ | 猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
(5)步骤①的目的是____________________________
(6)利用该方法获得氧气的化学方程式为________________
(7)步骤④得到的固体是CuO。CuO的相对分子质量是_______________,其中铜元素的质量分数是________________。