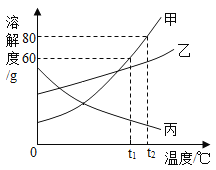
题目内容
【题目】用黄铜矿废液[溶质成份为Fe2(SO4)3、CuSO4及H2SO4]为原料,制备氢氧化铁并回收铜的生成流程如图,已知:Fe2(SO4)3+Fe→3FeSO4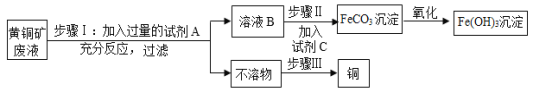
①步骤①中,加入过量A的目的是______;反应过程中观察到的现象之一是有气泡产生,写出该反应的化学方程式______。
②步骤Ⅱ中,试剂C的化学式可能为______。
③步骤Ⅲ中,用化学方法回收铜的操作步骤为:加入过量的______、过滤、______、干燥。
④在生产流程中,能说明铁的活动性比铜强的是步骤______(选填“Ⅰ”、“Ⅱ”或“Ⅲ”)
【答案】使废液中Fe2(SO4)3、CuSO4及H2SO4全部转化为硫酸亚铁 ![]() NaOH等 稀硫酸 洗涤 I、III
NaOH等 稀硫酸 洗涤 I、III
【解析】
①步骤①中,由于黄铜矿废液[溶质成份为Fe2(SO4)3、CuSO4及H2SO4]且实验目的是制取氢氧化铁和铜,所以加入过量A的目的是使废液中Fe2(SO4)3、CuSO4及H2SO4全部转化为硫酸亚铁;由于只有铁和硫酸反应生成气体,反应过程中观察到的现象之一是有气泡产生,对应的是铁和硫酸反应生成硫酸亚铁和氢气,化学方程式![]() 。
。
②步骤Ⅱ中,由于是硫酸亚铁和C反应且生成氢氧化亚铁,所以试剂C为可溶性碱,对应的化学式可能为 NaOH等。
③步骤Ⅲ中,用化学方法回收铜是除去铜粉中铁,所以根据铁的性质可以选用盐酸或者硫酸,如果考虑综合利用,最好时使用硫酸,以便生成的硫酸亚铁在过程中利用。所以操作步骤为:加入过量的 稀硫酸、过滤、洗涤、干燥。
④在生产流程中,I中铁和硫酸铜反应生成硫酸亚铁和铜,说明铁比铜活泼。III中铁和铜的混合物加入稀硫酸,只有铁和硫酸反应而铜与硫酸不反应也说明铁比铜活泼。所以能说明铁的活动性比铜强的是步骤 I、III。

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目