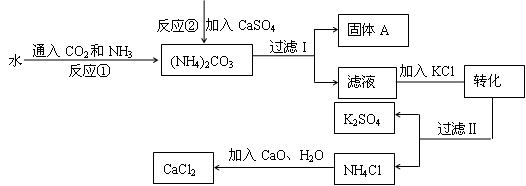
题目内容
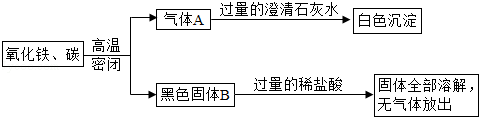
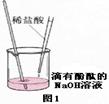
如图所示的实验中,反应前氧化铁和碳粉的质量分别为16克和0.6克,反应后得到气体A和14.4克黑色固体B.
(1)计算白色沉淀的质量;
(2)通过计算推断黑色固体B的化学式.

(1)计算白色沉淀的质量;
(2)通过计算推断黑色固体B的化学式.
(1)10g;(2)FeO.
试题分析:(1)由题意可知,生成的气体A是二氧化碳,生成二氧化碳的质量=16g+0.6g﹣14.4g=2.2g
设生成白色沉淀的质量为x
CO2+Ca(OH)2=CaCO3↓+H2O
44 100
2.2g x
根据:
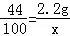 解得x=10g
解得x=10g(2)根据现象判断黑色固体没有铁和碳.
氧化铁中含铁元素的质量=16g×
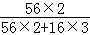 ×100%=11.2g;
×100%=11.2g;根据反应前后元素种类不变,则B中铁元素的质量为11.2g,则黑色固体B中含氧元素的质量=14.4g﹣11.2g=3.2g
若固体B的化学式为FexOy,由化合物中
原子的个数比=
 则x:y=
则x:y=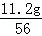 :
: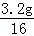 =1:1;
=1:1;所以固体B的化学式为:FeO.

练习册系列答案
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
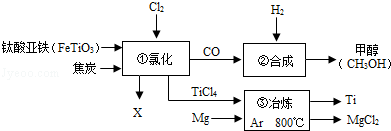
 2X+2TiCl4+6CO,则X为FeCl3
2X+2TiCl4+6CO,则X为FeCl3