题目内容
现有两种金属单质组成的混合物。向100 g稀盐酸中加入该混合物,加入混合物的质量与生成氢气的质量关系如图所示。下列说法正确的是
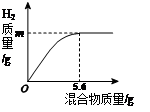
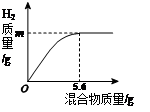
| A.若混合物为Zn和Cu,则m大于0.2 g |
| B.若混合物为Zn和Fe,则m可能是0.2 g |
| C.若混合物为Fe和Cu,稀盐酸中溶质质量分数为7.3% |
| D.若混合物为Fe和Cu,m为0.1 g,则混合物中Fe和Cu的质量比为1:1 |
D
试题分析:A、根据锌稀盐酸的反应:Zn + 2HCl="==" ZnCl2 + H2↑,Zn与H2的质量比为65:2,假设纯净的锌为5.6g,生成的氢气小于0.2g,而铜不与盐酸反应,根据中间取值的原则,所以若混合物为Zn和Cu,则m小于0.2 g,错误,B、由于5.6g锌与盐酸反应生成氢气的质量小于0.2g,而根据铁与盐酸的反应:Fe + 2HCl= FeCl2 + H2↑,假设纯净的铁为5.6g,生成的氢气等于0.2g,根据中间取值的原则,若混合物为Zn和Fe,则m小于0.2 g,错误,C、由于m的值不确定,混合物中Fe的质量也不知道,所以稀盐酸中溶质质量分数无法计算,错误,D、如果m为0.1 g,根据铁与盐酸的反应:Fe + 2HCl= FeCl2 + H2↑中铁与氢气的质量关系为28:1,可知铁的质量为2.8g,所以若混合物为Fe和Cu,则混合物中Fe和Cu的质量比为2.8g:(5.6g-2.8g)=1:1,,正确,故选D

练习册系列答案
相关题目