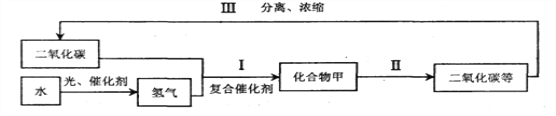
题目内容
【题目】下列实验设计能达到目的是( )
选项 | A | B | C | D |
实验设计 |
|
|
|
|
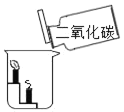
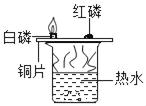
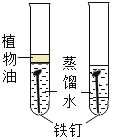
实验目的 | 证明二氧化碳与水反应生成碳酸 | 证明二氧化碳不可燃、不助燃、密度大于空气 | 证明可燃物燃烧需要氧气和温度达到着火点 | 证明铁生锈是水和氧气共同作用的结果 |
A. AB. BC. CD. D
【答案】B
【解析】
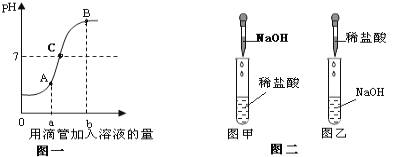
A、将二氧化碳倒入盛水的塑料瓶中,拧紧瓶盖后瓶子变瘪,只能证明二氧化碳溶于水或和水反应,不能证明二氧化碳和水反应生成碳酸,应该通过加入紫色的石蕊试液变成红色证明,故不能达到实验目的;
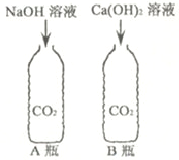
B、高低不等的蜡烛熄灭的顺序说明二氧化碳的密度比空气大,蜡烛熄灭说明二氧化碳不能燃烧也不能支持燃烧的性质,故能达到实验目的;
C、铜片上的白磷燃烧,红磷不燃烧,只能证明燃烧与温度是否达到可燃物的着火点有关,不能证明是否需要氧气,故不能达到目的;
D、铁生锈是铁与水、氧气共同作用的结果,图示实验只能说明铁在水中不易生锈,应补充一个铁钉不与水接触的实验即在干燥的空气中,故不能达到实验目的。
故选:B。

 习题精选系列答案
习题精选系列答案【题目】红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示。同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究。

(提出问题)久置固体的成分是什么?
(查阅资料)铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
(猜想)久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。
(实验探究1)甲同学的方案:
实验操作 | 实验现象 | 实验结论 |
(1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红 | 固体中一定含有____和Ca(OH)2. |
(2)另取少量固体放于试管中,滴加足量的____ | 固体逐渐消失,有无色气体产生,得到浅绿色溶液 | 固体中一定含有Fe,一定不含Fe2O3 |
(3)将步骤(2)中产生的气体通入到澄清石灰水中 | ____ | 固体中一定含有CaCO3 |
(实验质疑)
(1)乙同学认为甲同学的实验中不能得出一定含Ca(OH)2的结论,理由是_____。
(2)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是_____。
(实验探究2)
乙、丙同学设计如下实验方案继续验证:
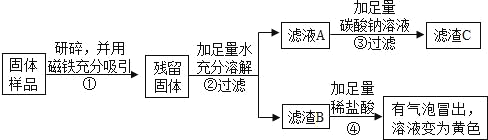
(1)③中反应的化学方程式是_____。
(2)乙、丙同学实验中能得出固体样品中一定还含有_____,仍有一种物质不能确定,该物质是_____。
(3)乙、丙同学又经过实验测得上述残留固体中含钙物质的总质量为1.6g,滤渣B中CaCO3的质量为1.0g,滤渣C的质量为1.0g。
(实验结论)综合上述实验及所给数据,久置固体的成分是_____。