题目内容
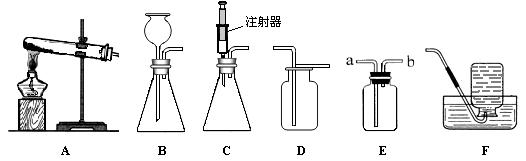
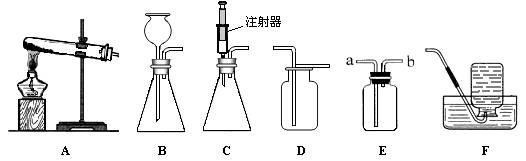
下图所示是实验室中制取气体时常用装置。请回答下列问题:
 (1)在实验室制取气体时,加入药品之前一定要先检验 。
(1)在实验室制取气体时,加入药品之前一定要先检验 。
(2)以石灰石和稀盐酸为原料制取并收集干燥的CO2气体。
①各装置的正确连接顺序是(填装置序号) 。
②产生CO2气体的化学方程式为 。
③检验集气瓶中是不是CO2气体的方法 。
(3)同学甲为验证制取CO2后剩余溶液中是否含有盐酸(杂质不溶于水且不参加反应,且CaCl2溶液呈中性),设计实验方案如下:取样于试管中,滴加AgNO3溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,则含有盐酸。你是否同意该方案?简述理由。
。
(4)将少量CO2气体通入盛有足量NaOH溶液的广口瓶中,瓶中溶液的质量与之前相比会(填写下列各项序号)。
A.增大 B.减小 C.不变 D.无法判断
(1)装置的气密性
(2)①ACE ②CaCO3+2HCl=CaCl2+2H2O +CO2↑③加入少量的澄清石灰水并振荡。若看到澄清的石灰水变浑浊,则是CO2
(3)不同意,因为溶液中一定含有CaCl2,不管是否有稀盐酸,都能和AgNO3溶液反应生成白色沉淀。
(4)A
【解析】
试题分析:(1)在实验室制取气体时,加入药品之前一定要先检查装置的气密性,以防止反应过程中生成的气体逸出;
(2)①实验室用大理石和稀盐酸反应制取二氧化碳,反应物的状态是固体和液体,反应条件是常温,故应选用发生装置A;由于二氧化碳的密度大于空气的密度,且二氧化碳能溶于水,故只能选用收集装置E;根据题意,要“收集干燥的CO2气体”,故在收集前要用浓硫酸进行干燥,所以各装置的正确连接顺序是ACE;
②大理石和稀盐酸反应制取二氧化碳的同时,还生成了氯化钙和水,故反应的化学方程式为CaCO3+2HCl=CaCl2+2H2O +CO2↑;
③由于二氧化碳能使澄清的石灰水变浑浊,故要检验CO2气体,可向集气瓶中加入少量的澄清石灰水并振荡,若看到澄清的石灰水变浑浊,则是CO2。
(3)由于大理石和稀盐酸反应后一定生成CaCl2,即溶液中一定含有CaCl2,故不管溶液中是否有稀盐酸剩余,都能和AgNO3溶液反应,并生成不溶于硝酸的白色沉淀,因此该方案不完善。
(4)由于二氧化碳能和氢氧化钠反应生成碳酸钠和水,因此将少量CO2气体通入盛有足量NaOH溶液的广口瓶中时,二氧化碳会被NaOH溶液吸收,故瓶中溶液的质量与之前相比会增加。故选A
考点:常用气体的发生装置和收集装置与选取方法,证明盐酸和可溶性盐酸盐(Cl-检验方法)
点评:熟练掌握二氧化碳的实验室制法、原理、制取和收集装置的选择方法,二氧化碳的检验方法和可溶性Cl-的检验方法,是解答本题的关键。

 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案