题目内容
【题目】水蒸气通过炽热的焦炭可以得到水煤气(主要成分是CO和H2),化学方程式为C+H2O(气) ![]() CO+H2 ,
CO+H2 ,
(1)该反应是反应(填基本反应类型)。某兴趣小组的同学在实验室模拟了水煤气的制备,并设计实验验证水煤气中含有CO和H2。
(2)【查阅资料】白色的无水硫酸铜遇水会变成蓝色。
【设计实验】甲同学设计的实验装置如图所示: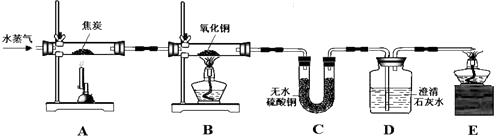
写出实验现象:B中固体 , C中固体变蓝,D中溶液。
(3)【改进实验】乙同学认为要想达到实验目的,在装置A、B之间还需增加装置F、G,其中F的作用是 , G的作用是。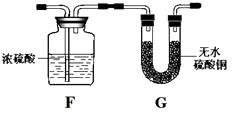
(4)【拓展探究】CO和H2的混合气在工业上可用于合成一系列化工原料和新型燃料,还可用于冶炼某些金属。
①“绿色化学”能实现零排放(即反应物中的原子利用率达到100%)。根据零排放的要求,不可能以CO和H2为原料合成的有机物是(填字母)。
A.甲醇(CH3OH) B.乙醇(C2H5OH) C.甲醛(CH2O) D.乙酸(CH3COOH)
②若用CO和H2的混合气冶炼铁,混合气所起的作用是。
【答案】
(1)置换
(2)变红;变浑浊
(3)除去水蒸气;检验水蒸气是否已被全部除去
(4)B;将铁从铁矿石中还原出来(或“作还原剂”)
【解析】(1)反应物一种是单质、一种是化合物,生成物一种是单质、一种是化合物,符合置换反应的概念;【设计实验】当水蒸气通过装置A后,得到了氢气和一氧化碳,两种气体均具有还原性,在加热的条 件下能将氧化铜还原为金属铜,故观察到黑色固体慢慢变成红色;一氧化碳与氧化铜反应生成了二氧 化碳,二氧化碳与氢氧化钙溶液反应生成碳酸钙白色沉淀和水,所以观察到澄清的石灰水变浑浊;【改进实验】水蒸气与碳可能没有完全反应而有剩余,对后面的实验起到了干扰的作用,所以在装置A、B之间还需增加装置F、G,其中F的作用是除去水蒸气,G的作用是检验水蒸气是否已被全部除去;【拓展探究】①“绿色化学”能实现零排放,即反应物中的原子利用率达到100%,也就是说反应 类型一般是化合反应,且反应后产物中的各原子数目比不变,CO和H2在一定条件下按照不同的比例 反应,可假定反应时的化学计量数之比为m∶n,则只要各选项中的化学式能化为形式(CO)m(H2)n , 都是 正确的。A、甲醇(CH4O)可变为(CO)1(H2)2 , 正确;B、乙醇(C2H6O)不能化为形式(CO)m(H2)n , 错误;C、甲 醛(CH2O)可变为(CO)1(H2)1 , 正确;D、乙酸(C2H4O2)可变为(CO)2(H2)2 , 正确。故选B。