题目内容
【题目】张宁和刘明同学学习完酸、碱、盐后发现:碱溶液能使酚酞溶液变红,Na2CO3溶液也能使酚酞溶液变红。通过学习知道,碱溶液使酚酞溶液变红,是因为碱在水中离解出OH-,那么Na2CO3溶液中究竟是哪种粒子使酚酞溶液变红呢?请你帮助他俩完成实验探究。
【提出问题】Na2CO3属于 (填“酸”、“碱”、“盐”),为什么能使酚酞溶液变红?
【进行猜想】
(1)Na+使酚酞溶液变红。
(2)水分子使酚酞溶液变红。
(3) 使酚酞溶液变红。
【设计实验】
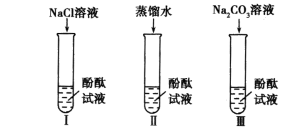
(1)实验Ⅰ的目的是为了验证猜想 不成立。
(2)刘明同学认为实验Ⅱ没必要做,他的理由是 。
(3)实验Ⅲ滴入Na2CO3溶液,振荡,酚酞试液变 红。向变红后的溶液中滴加CaCl2溶液至过量,振荡,出现的现象是 ,反应的化学方程式是 。(提示:CaCl2溶液呈中性)
(4)由实验Ⅰ、Ⅱ、Ⅲ得出猜想(3)正确。张宁对此结论有些质疑,于是他查阅资料。
【查阅资料】Na2CO3溶液中,CO2-3和H2O发生如下反应:CO2-3+H2O=====HCO-3+OH-
【得出结论】Na2CO3溶液中使酚酞溶液变红的粒子是 。
【答案】【提出问题】盐;【进行猜想】CO32﹣【设计实验】(1)探究Na+是否能使酚酞试液变红;(2)酚酞试液中就有水分子(或氯化钠溶液中含有水分子);(3)白色沉淀; Na2CO3+CaCl2═CaCO3↓+2NaCl;(4)OH﹣.
【解析】
试题分析:【提出问题】碳酸钠能电离出钠离子和碳酸根离子,所以属于盐;
【进行猜想】碳酸钠溶液中存在钠离子、碳酸根离子、水分子;
【设计实验】
(1)向氯化钠溶液中加酚酞不变色,说明氯化钠溶液中的粒子都不能使酚酞变红;
(2)氯化钠溶液中含有大量水分子,在实验(1)中得到验证,所以实验(2)的探究是多余的;
(3)碳酸钠溶液和氯化钙溶液反应生成碳酸钙沉淀,所以现象为红色逐渐消失,产生白色沉淀;化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl;
(4)我们知道只有氢氧根离子才能使酚酞变红,所以由碳酸钠溶液能使酚酞溶液变红,可以判断溶液中存在氢氧根离子


