题目内容
【题目】盐城濒临黄海,海水中含有NaCl、CaCl2等
(1)下列方法中能淡化海水的是_____(填字母)。
A分解法 B吸附法 C蒸馏法
(2)从海水中获取粗盐,宜选用_____(填“蒸发结晶”或“降温结晶”)。为了除去粗盐溶液中的Ca2+、Mg2+、SO42﹣,可按照下列实验步骤进行:①加过量BaC12溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④操作X;⑤加入适量盐酸。其中步骤③加过量Na2CO3溶液的目的是_____:步骤④操作X的名称是_____。
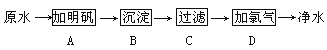
(3)海水提镁流程:
![]()
写出b步骤发生反应的化学方程式_____,提取氯化镁历经a、b两步转换的目的是_____。经过a步骤生成的氢氧化镁需要洗涤,检验氢氧化镁是否洗净的方法是:取少量最后一次洗涤液于试管中,滴加少量稀硝酸和_____溶液,若无白色沉淀生成,说明已洗净。
(4)如为氯化钠在不同温度时的溶解度。结合表中数据回答:
温度/℃ | 30 | 50 | 70 | 100 |
溶解度/g | 36.3 | 37.0 | 37.8 | 39.8 |
配制100g质量分数为10%的氯化钠溶液,所需50℃的氯化钠饱和溶液质量为_____g(结果精确到1g)。
(5)CaCl2应用广泛,以石灰石(杂质主要是Fe2O3、MgSO4)为原料生产CaCl2的流程如图:
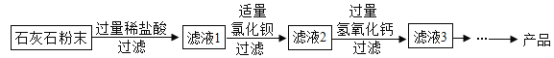
①液1中的溶质有HCl、FeCl3、MgSO4和_____(填化学式)。
②滤液2中加入Ca(OH)2可以除去HCl、MgCl2和_____(填化学式)。
【答案】C 蒸发结晶 除去溶液中的钙离子和过量的钡离子 过滤 Mg(OH)2+2HCl=MgCl2+2H2O 获得比较纯净的氯化镁 硝酸银 37 CaCl2 FeCl3
【解析】
(1)蒸馏得到的水是纯水,蒸馏法是常用的淡化海水的方法,故选C;
(2)氯化钠的溶解度受温度的影响比较小,所以采用蒸发溶剂结晶法获得粗盐;碳酸钠中的碳酸根离子能与钙离子、钡离子产生碳酸钙沉淀和碳酸钡沉淀,加入过量碳酸钠溶液的目的是除去溶液中的钙离子和过量的钡离子;步骤④需要将生成的沉淀分离出去,所以是过滤操作;
(3)步骤b中氢氧化镁与盐酸反应生成氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O;提取氯化镁历经 a、b两步转换是为了获得比较纯净的氯化镁;过滤出的氢氧化镁表面可能有氯化钠等物质,所以经过a步骤生成的氢氧化镁需要洗涤,氯化钠与硝酸银反应生成氯化银沉淀和硝酸钠,检验氢氧化镁是否洗净的方法是:取少量最后一次洗涤液于试管中,滴加少量稀硝酸和硝酸银溶液,若无白色沉淀生成,说明已洗净;
(4)由数据可知,50℃时,氯化钠的溶解度为37.0g,则该温度下的饱和溶液中溶质的质量分数为=![]() ;
;
设:配制100g质量分数为10%的氯化钠溶液,所 需50℃的氯化钠饱和溶液质量为x,则:
![]() x≈37g;
x≈37g;
(5)①石灰石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳;其中的杂质氧化铁与盐酸反应生成氯化铁和水,所以滤液1中的溶质有HCl、FeCl3、MgSO4和CaCl2;
②氯化镁、氯化铁、盐酸对于氯化钙来说,也是杂质,都会与氢氧化钙反应生成氯化钙,滤液2中加入Ca(OH)2可以除去HCl、MgCl2和FeCl3。

【题目】食盐是人类生存的必需品,获取食盐的途径有多种。
(1)开采岩盐。地下盐层含氯化钠、硫酸钠等物质,构成硫酸钠的阴离子是_____ (填符号)。 除去氯化钠溶液中的硫酸钠应选用的试剂是_____(填化学式)溶液。
(2)熬制井盐。用井中产生的天然气作为燃料熬制井盐。CH4燃烧的化学方程式是_____。
(3)海水晒盐。某地海水中主要物质的含量见表。 该海水中氯化钠的质量分数为_____,配制某氯化钠溶液需 85mL 水,应选用量筒的规格为_____mL。
物质 | 每 100g 海水所含质量(g) |
水 | 96.5 |
氯化钠 | 2.7 |
硫酸钠 | 0.2 |
…… | …… |
(4)松花蛋的制作过程也需用氯化钠,还有生石灰、纯碱等,制作料泥时将上述原料加入水中,混合均匀即可。
从物质分类的角度看,该料泥是_____物,料泥中的“纯碱”是_____(填物质的名称) 的俗称;原料中可以做干燥剂的物质是_____(填化学式),它与水发生反应的化学方程式为_____,该反应过程_____热量(填“放出”或“吸收”)。
【题目】根据下列溶解度曲线和A物质的部分温度是的溶解度判断下列说法正确的是( )
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | A物质 | 20 | 28 | 45 | 60 |
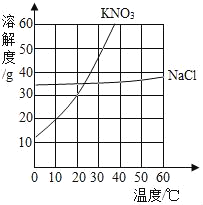
A. 由上图可知,KNO3和NaCl的溶解度均大于A 物质的溶解度
B. 10℃时,将40gNaCl放入50g水中,充分溶解,所得溶液是NaCl的不饱和溶液
C. 将30℃时NaCl、KNO3、和A物质的饱和溶液各降温至10℃,所得溶液的溶质质量分数大小为:KNO3>NaCl>A
D. 20℃时,将KNO3、NaCl和A物质各30g分别配制成恰好饱和溶液,所得溶液的质量大小为A>KNO3=NaCl
【题目】分析处理图表信息是学习的一种重要方法。如表是氯化钠、硝酸钾、氢氧化钙在不同温度下的溶解度。这三种固体物质的溶解度曲线如图所示。
温度/℃ | 20 | 40 | 60 | 80 | |
溶解度/g | NaCl | 36.0 | 36.6 | 37.3 | 38.4 |
KNO3 | 31.6 | 63.9 | 110 | 169 | |
Ca(OH)2 | 0.16 | 0.14 | 0.12 | 0.095 | |
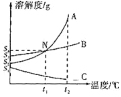
请仔细阅读图表后回答下列问题:
(1)A曲线表示的是_____的溶解度曲线。
(2)除去A中少量的B,步骤是:加水溶解,蒸发浓缩,_____,过滤,洗涤,干燥。
(3)20℃时,将氯化钠、硝酸钾、氢氧化钙各10g分别加入盛有50g水的烧杯中,充分溶解,测得三种溶液中溶质的质量分数分别为a%、b%、c%,则三者之间的大小关系是_____。
(4)现有一杯饱和溶液,是A、B、C三种饱和溶液中的一种,将其加热时出现浑浊现象,则这杯饱和溶液的溶质是_____。