题目内容
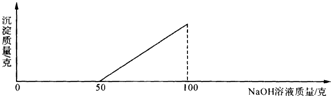
在硫酸与硫酸铜的混合溶液200g中,滴入40%的NaOH溶液100g,恰好完全反应,记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示.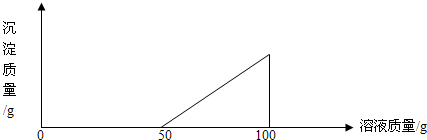
回答:
(1)与硫酸铜反应的氢氧化钠溶液的质量为
(2)计算生成氢氧化铜沉淀的质量.
(3)求最后所得溶液的质量分数.
分析:(1)根据图象可以看出,当氢氧化钠溶液的质量为50克时,沉淀开始出现;当氢氧化钠溶液的质量为100克时,沉淀的质量达到最大值.所以与硫酸铜反应的氢氧化钠溶液的质量为(100-50)克.
(2)写出化学方程式并代入氢氧化钠的质量算出氢氧化铜沉淀的质量.
(3)根据化学方程式分别算出溶质和溶液的质量即可.
(2)写出化学方程式并代入氢氧化钠的质量算出氢氧化铜沉淀的质量.
(3)根据化学方程式分别算出溶质和溶液的质量即可.
解答:解:(1)根据图象可以看出,当氢氧化钠溶液的质量为50克时,沉淀开始出现;当氢氧化钠溶液的质量为100克时,沉淀的质量达到最大值.所以与硫酸铜反应的氢氧化钠溶液的质量为(100-50)克,故答案为:50克.
(2)由(1)可知,与硫酸铜反应的氢氧化钠溶液的质量为(100-50)克,则氢氧化钠的质量=50克×40%═20克,设生成的氢氧化铜沉淀的质量为X,生成的硫酸钠的质量为Y.
2NaOH+CuSO4═Na2SO4+Cu(OH)2↓
80 142 98
20克 Y X
═
得:X=24.5克
═
得:Y=35.5克
(3)从图象可以看出,硫酸和氢氧化钠生成硫酸钠和水,因此刚开始没有沉淀生成,消耗的氢氧化钠溶液的质量为50克,则氢氧化钠的质量=50克×40%═20克,设生成的硫酸钠的质量为Z.
H2SO4+2NaOH═Na2SO4+2H2O
80 142
20克 Z
═
得:Z=35.5克
∴反应后溶液中溶质的质量=35.5克+35.5克=71克,溶液的质量=200克+100克-24.5克=275.5克.
∴反应后溶液中溶质的质量分数=
×100%═25.77%.
答:生成氢氧化铜沉淀的质量为24.5克,最后所得溶液的质量分数为25.77%.
(2)由(1)可知,与硫酸铜反应的氢氧化钠溶液的质量为(100-50)克,则氢氧化钠的质量=50克×40%═20克,设生成的氢氧化铜沉淀的质量为X,生成的硫酸钠的质量为Y.
2NaOH+CuSO4═Na2SO4+Cu(OH)2↓
80 142 98
20克 Y X
| 80 |
| 98 |
| 20克 |
| X |
得:X=24.5克
| 80 |
| 142 |
| 20克 |
| Y |
得:Y=35.5克
(3)从图象可以看出,硫酸和氢氧化钠生成硫酸钠和水,因此刚开始没有沉淀生成,消耗的氢氧化钠溶液的质量为50克,则氢氧化钠的质量=50克×40%═20克,设生成的硫酸钠的质量为Z.
H2SO4+2NaOH═Na2SO4+2H2O
80 142
20克 Z
| 80 |
| 142 |
| 20克 |
| Z |
得:Z=35.5克
∴反应后溶液中溶质的质量=35.5克+35.5克=71克,溶液的质量=200克+100克-24.5克=275.5克.
∴反应后溶液中溶质的质量分数=
| 71克 |
| 275.5克 |
答:生成氢氧化铜沉淀的质量为24.5克,最后所得溶液的质量分数为25.77%.
点评:培养学生分析图象的能力,掌握化学方程式的计算格式和规范性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
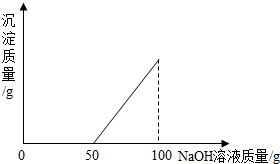 在硫酸与硫酸铜的混合溶液200g中,滴入40%的氢氧化钠溶液100g,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示.问:
在硫酸与硫酸铜的混合溶液200g中,滴入40%的氢氧化钠溶液100g,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示.问: