题目内容
在硫酸与硫酸铜的混合溶液200克中,滴入40%的氢氧化钠溶液100克,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示.问: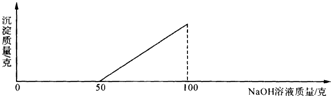
(1)与硫酸铜反应的氢氧化钠溶液的质量为
(2)完全反应后,滤去沉淀物再将滤液倒入一个底面积为50平方厘米的圆柱形容器中,求容器底部受到的液体压强.(g=10牛/千克,滤液损失忽略不计)
(3)将容器中的溶液在t℃时恒温蒸发27克水后,恰好达到饱和,求t℃时溶质的溶解度.
分析:根据已有的知识进行分析,硫酸能与氢氧化钠反应生成硫酸钠和水,氢氧化钠能与硫酸铜反应生成氢氧化铜沉淀,氢氧化铜能与硫酸反应生成硫酸铜和水,根据图象,开始时是氢氧化钠与硫酸反应,硫酸反应完硫酸铜再与氢氧化钠反应,根据液体压强公式即可求得容器底部所受的压强,根据溶液中溶质的质量和溶剂的质量即可求得溶解度.
解答:解:(1)硫酸能与氢氧化钠反应生成硫酸钠和水,氢氧化钠能与硫酸铜反应生成氢氧化铜沉淀,氢氧化铜能与硫酸反应生成硫酸铜和水,根据图象,开始时是氢氧化钠与硫酸反应,硫酸反应完硫酸铜再与氢氧化钠反应,故与硫酸铜反应的氢氧化钠溶液的质量为50g,所以本题答案为:50;
(2)设与硫酸铜反应生成的Cu(OH)2和Na2SO4质量分别为x和y.
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
80 98 142
50g×40% x y
=
x=24.5g
=
y=35.5g
滤液质量=200g+100g-24.5g=275.5g
p=
=
=551(帕)
(3)设与硫酸反应生成的Na2SO4质量z.
H2SO4+2NaOH=2H2O+Na2SO4
80 142
50g×40% z
=
z=35.5g
饱和溶液中溶质的质量=35.5g+35.5g=71g
饱和溶液中溶剂的质量=200g+100g-24.5g-71g-27g=177.5g
设t℃时溶质的溶解度为S
=
S=40g
答:(1)与硫酸铜反应的氢氧化钠溶液的质量为50克.
(2)容器底部受到的液体压强为551帕.
(3)t℃时溶质的溶解度为40克.
(2)设与硫酸铜反应生成的Cu(OH)2和Na2SO4质量分别为x和y.
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
80 98 142
50g×40% x y
| 80 |
| 20g |
| 98 |
| x |
x=24.5g
| 80 |
| 20g |
| 142 |
| y |
y=35.5g
滤液质量=200g+100g-24.5g=275.5g
p=
| F |
| S |
| 0.2755×10 |
| 0.005 |
(3)设与硫酸反应生成的Na2SO4质量z.
H2SO4+2NaOH=2H2O+Na2SO4
80 142
50g×40% z
| 80 |
| 20g |
| 142 |
| z |
z=35.5g
饱和溶液中溶质的质量=35.5g+35.5g=71g
饱和溶液中溶剂的质量=200g+100g-24.5g-71g-27g=177.5g
设t℃时溶质的溶解度为S
| S |
| 100g |
| 71g |
| 177.5g |
S=40g
答:(1)与硫酸铜反应的氢氧化钠溶液的质量为50克.
(2)容器底部受到的液体压强为551帕.
(3)t℃时溶质的溶解度为40克.
点评:本题考查了酸和碱之间的反应以及碱和盐的反应和有关的计算,完成此题,可以依据已有的知识及溶解度的定义进行.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
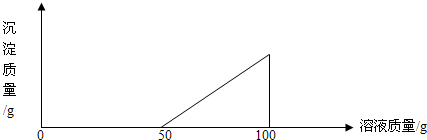
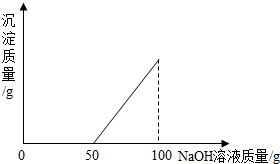 在硫酸与硫酸铜的混合溶液200g中,滴入40%的氢氧化钠溶液100g,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示.问:
在硫酸与硫酸铜的混合溶液200g中,滴入40%的氢氧化钠溶液100g,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示.问: