题目内容
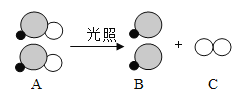
【题目】下图所示为实验室常用的实验装置:
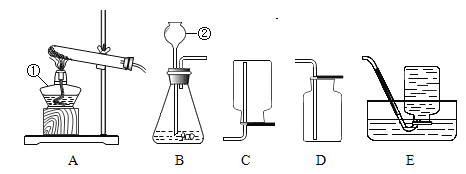
回答下列问题:
(1)写出带标号②仪器的名称:_____。若实验室制取氧气的发生装置可以选用A,则选择的依据是什么_____?写出用氯酸钾为原料制取氧气的化学方程式_____。
(2)实验室制取并收集一瓶二氧化碳气体应选择的装置是_____。
(3)CO2还可以用碳酸氢钠(NaHCO3)加热分解(产物为碳酸钠、二氧化碳和水)来制取,该反应的化学方程式为:_____。
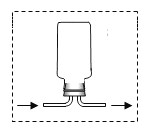
(4)下图为同学利用报废试管设计的制二氧化碳的发生装置,该设计出了废物利用的优点外,请另写一个优点:_____。
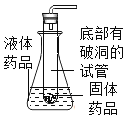
若用如下图装置按箭头所示的流向收集一瓶二氧化碳气体,请将集气瓶内的导管补画完整_____。
(5)取溶质质量分数为8.5%的过氧化氢溶液20g倒入烧杯中,在催化剂的作用下使其完全分解,计算理论上共能产生氧气多少克_____?
【答案】长颈漏斗 反应物是固体,反应条件是加热  BD
BD ![]() 节约药品、可随时控制反应发生或停止
节约药品、可随时控制反应发生或停止  0.8g
0.8g
【解析】
(1)标号②仪器的名称为长颈漏斗。若实验室制取氧气的发生装置可以选用A,A为固-固加热型发生装置,则选择的依据是反应物是固体,反应条件是加热;用氯酸钾为原料制取氧气,氯酸钾在二氧化锰作催化剂的条件下分解生成氯化钾和氧气,反应的化学方程式为 。
。
(2)实验室制二氧化碳的原理是大理石或石灰石与稀盐酸反应生成二氧化碳、氯化钙和水,选择固液不加热型发生装置,二氧化碳密度比空气密度大,溶于水且与水反应,选择向上排空气法收集装置,综上所述,实验室制取并收集一瓶二氧化碳气体应选择的装置是BD。
(3)CO2还可以用碳酸氢钠(NaHCO3)加热分解(产物为碳酸钠、二氧化碳和水)来制取,该反应的化学方程式为![]() 。
。
(4)如图所示为同学利用报废试管设计的制二氧化碳的发生装置,该设计出了废物利用的优点外,通过向上提起底部有破洞的试管,固体药品与液体药品就会分离,反应就会停止,因此还有节约药品、可随时控制反应发生或停止的优点。二氧化碳的密度比空气密度大,若用倒置的万用瓶通过排空气法收集二氧化碳,二氧化碳应该从短管进,则集气瓶内的导管应该为 。
。
(5)由题意20g8.5%的过氧化氢溶液含有过氧化氢的质量为![]() ,设理论上共能产生氧气的质量为x,则有:
,设理论上共能产生氧气的质量为x,则有:

由![]() 解得x=0.8g
解得x=0.8g
答:质量分数为8.5%的过氧化氢溶液20g完全分解理论上共能产生氧气0.8g。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案【题目】小丽在实验室发现一瓶氢氧化钠固体没有塞上瓶塞,于是她和同学一起对这瓶氢氧化钠固体是否变质展开探究。
(查阅资料)氯化钙溶液显中性。
(提出问题)这瓶氢氧化钠固体是否变质?
(作出猜想)猜想1:没有变质;猜想2:部分变质;猜想3:_____。
(实验推断)取氢氧化钠固体样品溶于水配成溶液A,进行如下实验:
实验操作 | 实验现象 | 实验结论 |
(1)取少量溶液A于试管中,向其中滴加足量的稀盐酸; | 有气泡产生 | 猜想____不成立 |
(2)另取少量溶液A于试管中,加入过量的氯化钙溶液 | ____ | 反应的化学方程式是____。 |
(3)向(2)所得的滤液中滴入几滴酚酞试液 | 酚酞试液变红 | 证明有_____存在。 |
综合以上实验,说明猜想____成立。 | ||
(反思)因此,氢氧化钠应____保存。