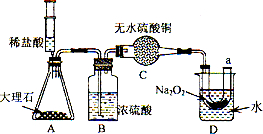
题目内容
23、已知CaCl2 和Na2CO3能发生复分解反应,下列所示的图象能反映相对应实验的是( )
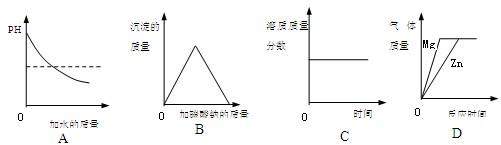

分析:溶液的质量分数大小与溶液的PH大小存在一定的关系.生成物的质量与反应物的质量多少有关.恒温蒸发饱和溶液时有固体析出.如果镁和锌足量时,生成的氢气的量决定于硫酸的质量.
解答:解:A、氢氧化钠溶液稀释过程中,PH不可能小于7.故错
B、根据生成气体水优先于沉淀,所以碳酸钠首先与盐酸反应然后与氯化钙反应,故起始无沉淀.故错
C、恒温蒸发饱和硝酸钾溶液时,析出固体的质量应该持续增加,溶质质量分数保持不变.故对
D、足量镁和锌分别与硫酸反应时,生成的氢气质量相等,并且因为镁比锌活泼,所以反应速率快.故对
故选C、D
B、根据生成气体水优先于沉淀,所以碳酸钠首先与盐酸反应然后与氯化钙反应,故起始无沉淀.故错
C、恒温蒸发饱和硝酸钾溶液时,析出固体的质量应该持续增加,溶质质量分数保持不变.故对
D、足量镁和锌分别与硫酸反应时,生成的氢气质量相等,并且因为镁比锌活泼,所以反应速率快.故对
故选C、D
点评:本题主要考查了如何根据图中信息正确判断说法的正误问题.

练习册系列答案
相关题目
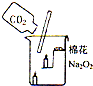 27、过氧化钠(Na2O2)是一种黄色固体.某次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入右图烧杯中,缓慢倒人CO2后发现处于下位的蜡烛先熄灭,上位的后熄灭,同时又惊奇的发现棉花燃烧起来.
27、过氧化钠(Na2O2)是一种黄色固体.某次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入右图烧杯中,缓慢倒人CO2后发现处于下位的蜡烛先熄灭,上位的后熄灭,同时又惊奇的发现棉花燃烧起来.