题目内容
【题目】(14分)研究性学习小组甲对教材实验结论“葡萄糖与新制氢氧化铜反应生成的红色沉淀是氧化亚铜(Cu2O),提出质疑,他们认为红色沉淀不一定全是氧化亚铜。为了确定红色沉淀的成分,开展了如下研究:
提出猜想:红色沉淀可能是①Cu2O。②Cu2O和Cu
查阅资料:①氧化亚铜能与酸反应,得到+2价的铜盐和单质铜;
②在空气中灼烧氧化亚铜生成氧化铜;
研究性学习小组甲设计出三种方案来验证猜想
方案1:取该红色沉淀加入稀盐酸中,观察溶液是否变蓝;
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣;
方案3:称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次直到固体恒重,称得质量为b g,比较a,b关系;
(1)葡萄糖的化学式为 ,属于 (填”有机物”或”无机物”),检验葡萄糖用的新制氢氧化铜由硫酸铜溶液与氢氧化钠溶液反应生成,反应的化学方程式为
(2)根据查阅资料,写出氧化亚铜与稀硫酸的反应方程式 。
研究性学习小组甲设计出三种方案你认为合理的方案是 。
研究性学习小组乙设计新的探究方案探究红色沉淀成份,装置如下图所示。
已知①2NH3+3Cu2O![]() N2+6Cu+3H2O
N2+6Cu+3H2O
②浓氨水与固体CaO接触,会逸出大量氨气, 碱石灰是氧化钙和氢氧化钠的混合物可吸收水和二氧化碳
方案如下(1)连好装置,检查装置气密性
(2)准确称取28.8克的红色沉淀于玻璃管中
(3)先A处反应,通一段时间氨气后称量D质量为108.3克,
(4)加热装置C
(5)待D中恒重为111.9克时,停止加热,继续通氨气直到装置C完全冷却.
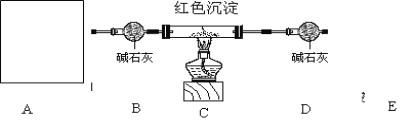
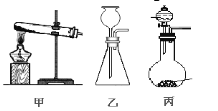
(3)A处为用浓氨水与固体CaO接触,以产生稳定持续的氨气,则A处的发生装置应选 (填”甲”,”乙”或”丙”),,
(4)B中碱石灰的作用是________________,加热前先通氨气的目的除了消除掉原来空气的的二氧化碳和水蒸汽对实验结果影响,还具有一个作用为 .
停止加热,继续通氨气除了让生成的铜充分冷却,还有的一个作用为 。
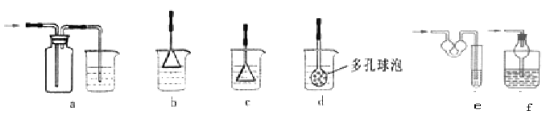
(5)为防止未反应的氨气扩散到空气中,E处可以连接的装置为 (液体均为稀硫酸,从下列选项中选择)
(6)红色沉淀的成份为 (通过计算说明共2分)
(7)有同学认为利用此实验装置还可以测定水中氢.氧元素的质量比,不过还需要测出一个数据,你认为要测出的数据为 (从下列选项中选择),
A.实验所消耗的氨气质量
B.B中干燥管中增加的质量
C.完全反应后玻璃管中固体质量
(8)下列情况会使测定水中氢、氧元素的质量比偏小的有 (从下列选项中选择)
A.红色沉淀未完全反应 B.红色沉淀未完全干燥
C.实验中缺少B装置 D.实验结束后未等铜完全冷却就拆除装置
【答案】(1)C6H12O6 有机物 CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
(2)Cu2O + H2SO4 ==== Cu +CuSO4 + H2O 方案3
(3)丙
(4)除去水 防止红色固体加热时被空气中氧气氧化 让生成的水蒸汽被完全吸收
(5)bef
(6)氧化亚铜
(7)C
(8)B
【解析】
试题分析:(1) 葡萄糖的化学式为:C6H12O6;组成中含有碳元素,属于有机物;硫酸铜溶液与氢氧化钠
溶液反反应的化学方程式为:CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
(2)根据资料:氧化亚铜能与酸反应,得到+2价的铜盐和单质铜,故氧化亚铜与稀硫酸的反应方程式为:Cu2O + H2SO4 == Cu+CuSO4+H2O;方案1:取该红色沉淀加入稀盐酸中,观察溶液是否变蓝;只能确定固体中含有Cu2O,方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣,只能确定固体中含有Cu,故研究性学习小组甲设计出三种方案你认为合理的方案是方案3
(3)气体发生装置的选择依据:反应物的状态和反应条件,A处为用浓氨水与固体CaO接触,故应从乙、丙中选择,由于还要产生稳定持续的氨气,故A处的发生装置应选丙,通过控制滴加液体的速率从而控制反应的速率
(4)B中碱石灰的作用是除去产生氨气中的水,防止对后面水的测定形成干扰;加热前先通氨气的目的除了消除掉原来空气的的二氧化碳和水蒸汽对实验结果影响,还具有一个作用为:防止红色固体加热时被空气中氧气氧化;停止加热,继续通氨气除了让生成的铜充分冷却,还有的一个作用为:让生成的水蒸汽被完全吸收
(5)为防止未反应的氨气扩散到空气中,应将氨气进行吸收处理,因为氨气能与浓硫酸反应,为了防止液体倒吸的现象,应增大吸收的面积,故E处可以连接的装置为bef
(6)根据装置D反应前后的质量变化,可判断反应生成水的质量=111.9g-108.3g=3.6g,然后根据化学方程式:2NH3+3Cu2O△N2+6Cu+3H2O中Cu2O与H2O的质量关系,求出Cu2O的质量
解:设Cu2O的质量为x
2NH3+3Cu2O△N2+6Cu+3H2O
432 54
x 3.6g
432:54=x:3.6g
x=28.8g
与原红色固体质量28.8克相等,故可判断红色沉淀的成份为Cu2O
(7)因为根据装置D反应前后的质量可判断生成水的质量,而根据化学反应:2NH3+3Cu2O△N2+6Cu+3H2O可知,Cu2O反应后变为单质Cu,减少的是氧元素质量,而减少的氧元素质量全部转化到了水中,故完全反应后玻璃管中固体质量,故利用此实验装置还可以测定水中氢、氧元素的质量比,不过还需要测出一个数据为:完全反应后玻璃管中固体质量(即生成水中氧元素的质量),故选C
(8)A、红色沉淀未完全反应,这对实验结果无影响,错误,B、红色沉淀未完全干燥,这样化学反应前后的质量差就会增大,使得氧元素的质量偏大,故会使测定水中氢、氧元素的质量比偏小,正确,C、实验中缺少B装置,会使装置D在反应前后的质量差偏大,即水的质量偏大,而氧元素质量不变,故氢元素质量偏大,故会使测定水中氢、氧元素的质量比偏大,错误,D、实验结束后未等铜完全冷却就拆除装置,这样生成的铜又被氧气氧化为氧化铜,使得装置D在反应前后的质量差偏小,即氧元素的质量偏小,故会使测定水中氢、氧元素的质量比偏大,错误,故选B