题目内容
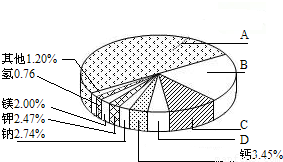
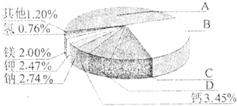
(2009?南京)从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答-下列问题:(1)地壳里各种元素的含量(质量分数)如右图所示,其中表示硅元素的是(填字母).
(2)根据元素周期表可知,原子序数为6的碳原子和原子序数为14的硅原子最外层电子数均为4,则常温下硅的化学性质(选琐“活泼”、“不活泼”).
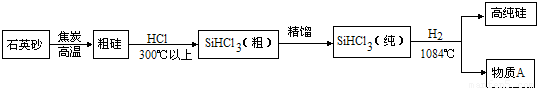
(3)制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法.生产过程示意如下:
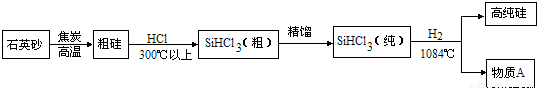
①整个制备过程必须达到无水无氧.在H2还原SiHCl3过程中若混入O2,可能引起的后果是.
②在生产过程中物质A可循环使用,A的化学式是;在生产过程中还有一种可循环使用的物质是.
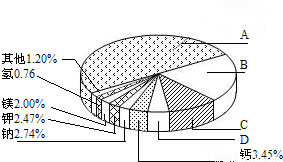
【答案】分析:(1)地壳里含量前四位的元素:氧元素、硅元素、铝元素、铁元素;
(2)根据元素周期表可知,原子序数为6的碳原子和原子序数为14的硅原子最外层电子数均为4,其化学性质相似,不易的电子,也不易失电子,故较稳定;
(3)①在H2还原SiHCl3过程中若混入O2,考虑氢气不纯,可能会爆炸;
②三氯甲硅烷(SiHCl3)与氢气反应,根据质量守恒定律的元素守恒,会反应生成硅和氯化氢,则氯化氢和焦炭都可循环使用.
解答:解:(1)因为硅元素在地壳里含量是第二位,故选B;
(2)利用知识迁移的方法,碳元素的化学性质较稳定,而硅元素的最外层电子数与之同,则其化学性质也应较稳定,故常温下硅的化学性质不活泼;
(3)①整个制备过程必须达到无水无氧.在H2还原SiHCl3过程中若混入O2,可能引起的后果是爆炸;
②在生产过程中物质A可循环使用,根据质量守恒定律的元素守恒,生成物A的化学式是HCl;在生产过程中还有一种可循环使用的物质是焦炭.
故答为:(1)B;(2)不活泼;(3)①爆炸;②HCl;焦炭.
点评:学会结合课本知识,学会进行知识的大胆迁移的方法;掌握地壳中元素的含量和分布.
(2)根据元素周期表可知,原子序数为6的碳原子和原子序数为14的硅原子最外层电子数均为4,其化学性质相似,不易的电子,也不易失电子,故较稳定;
(3)①在H2还原SiHCl3过程中若混入O2,考虑氢气不纯,可能会爆炸;
②三氯甲硅烷(SiHCl3)与氢气反应,根据质量守恒定律的元素守恒,会反应生成硅和氯化氢,则氯化氢和焦炭都可循环使用.
解答:解:(1)因为硅元素在地壳里含量是第二位,故选B;
(2)利用知识迁移的方法,碳元素的化学性质较稳定,而硅元素的最外层电子数与之同,则其化学性质也应较稳定,故常温下硅的化学性质不活泼;
(3)①整个制备过程必须达到无水无氧.在H2还原SiHCl3过程中若混入O2,可能引起的后果是爆炸;
②在生产过程中物质A可循环使用,根据质量守恒定律的元素守恒,生成物A的化学式是HCl;在生产过程中还有一种可循环使用的物质是焦炭.
故答为:(1)B;(2)不活泼;(3)①爆炸;②HCl;焦炭.
点评:学会结合课本知识,学会进行知识的大胆迁移的方法;掌握地壳中元素的含量和分布.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
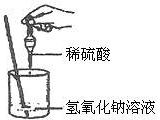
(2009?南京一模)如图所示,张同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀硫酸一会儿后,发现忘记了滴加指示剂,因而无法确定硫酸与氢氧化钠是否恰好完全反应.为了证明这两种物质是否恰好完全反应,张同学从烧杯中取出少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是张同学得出“两种物质已恰好完全中和”的结论.
(1)你认为张同学得出的结论是否正确______,理由是______;
(2)请你设计另一个实验,探究上述烧杯中的溶液是否恰好完全中和,填写下表
(3)张同学利用酸碱中和反应的原理来处理某工厂废水中所含有的硫酸.经测定,该工厂废水中硫酸的质量分数为15%,若工厂每天用含氢氧化钙75%的熟石灰处理150t这种废水(假设废水中其他物质不与氢氧化钙反应),需要熟石灰多少吨?(精确到0.01)
(1)你认为张同学得出的结论是否正确______,理由是______;
(2)请你设计另一个实验,探究上述烧杯中的溶液是否恰好完全中和,填写下表
| 试验方法 | 可能观察到的现象 | 结论 |


 (2009?南京)从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答-下列问题:
(2009?南京)从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答-下列问题: