题目内容
【题目】“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用。其过程的示意图如图。
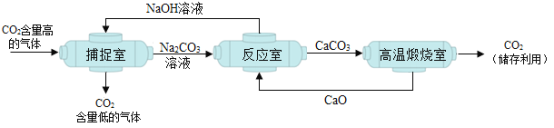
(1)除H2O外,上图中涉及的氧化物还有________。
(2)反应室中发生了如下化学变化:![]() ,
,![]() 。该过程中,碳元素的化合价为________。
。该过程中,碳元素的化合价为________。
(3)高温煅烧室中发生的反应为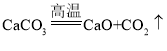 。若通过该反应释放22 t CO2,需要CaCO3的质量为_______ t。
。若通过该反应释放22 t CO2,需要CaCO3的质量为_______ t。
【答案】CO2、CaO +4 50
【解析】
(1)氧化物是由两种元素组成且其中一种是氧元素的化合物,上图中Na2CO3、CaCO3、NaOH这三种物质中虽然含氧元素,但是由三种元素组成,不属于氧化物;上图中CO2、CaO、H2O这三种物质都是由两种元素组成且其中一种是氧元素,属于氧化物,因此除H2O外,上图中涉及的氧化物还有:CO2、CaO。
(2)反应室中发生的两个反应中,只有![]() 中涉及到两种含碳物质Na2CO3和CaCO3,该反应是复分解反应,反应过程中元素的化合价不变,根据化合物中各元素化合价的代数和为0计算,Na2CO3、CaCO3中碳元素化合价均为+4,因此该过程中,碳元素的化合价为:+4。
中涉及到两种含碳物质Na2CO3和CaCO3,该反应是复分解反应,反应过程中元素的化合价不变,根据化合物中各元素化合价的代数和为0计算,Na2CO3、CaCO3中碳元素化合价均为+4,因此该过程中,碳元素的化合价为:+4。
(3)解:设需要CaCO3的质量为x。
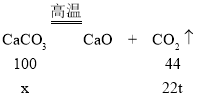
![]()
解得x=50t
答:需要CaCO3的质量为50t。

练习册系列答案
相关题目