题目内容
【题目】空气中氧气含量测定的再认识。
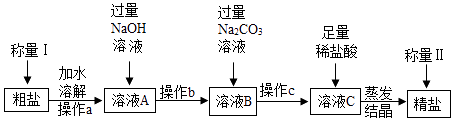
(1)【经典赏析】教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1)。
该实验中选择使用汞的优点有。
A.实验过程中没有污染
B.在汞槽中起到液封的作用
C.能将密闭装置内空气中的氧气几乎耗尽
D.生成的化合物加热分解又能得到汞和氧气
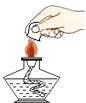
(2)【实验回顾】实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),当冷却至室温后,集气瓶内剩余气体的成分是。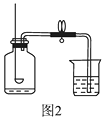
A.五氧化二磷
B.主要成份为氮气和氧气
C.纯净的氮气
D.主要成份为氮气的混合气体 兴趣小组的同学用该方法测出的氧气含量常常远低于 21%。
(3)【提出问题】用红磷燃烧的方法为什么测定空气中氧气的含量会偏小?
【进行猜想】①装置漏气;② , 装置内氧气有剩余;③;
(4)【实验与交流】在老师的指导下,凤九分别用过量的红磷和白磷进行该实验,用测定氧气浓度的 传感器测得反应后装置内氧气浓度分别为 8.85%和 3.21%。请从燃烧条件的角度分析产生上述两 个结果较大差异的主要原因是:。
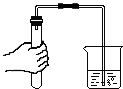
(5)【实验探究1】东华根据铁生锈的原理,探究用铁能否准确测定空气中 氧气的含量。于是进行了实验(装置如图 3)。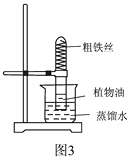
通过 7 天测得的数据计算出空气中氧气的含量为 19.13%。
【交流与反思】与用红磷燃烧的方法相比,用铁丝生锈的 方法测定的主要优点是:。
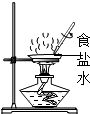
(6)【实验探究 2】为了加快反应速率,东华通过查阅资料,利用铁粉、炭 粉、氯化钠等物质又进行了实验(装置如图 4)。8 分钟后测得的数据如 下表:

请计算出空气中氧气含量为(计算结果保留一位小数)。
(7)【结论与反思】通过上述实验探究,选择(填物质名称)进行实验,可较为 快速地完成实验并减小实验误差。
(8)【拓展延伸】铜也能与空气中氧气、水、二氧化碳反应而锈蚀,生成铜绿[铜绿主要成分为 Cu2(OH)2CO3]。写出生成铜绿的化学方程式。若将图 3 装置中的粗铁丝 换成足量的铜丝进行实验,请判断能否比较准确地测定空气中氧气的含量,并说明理由。(相对原子质量:C-12 O-16)
【答案】
(1)B,C,D
(2)D
(3)红磷不足,实验前没有夹弹簧夹
(4)白磷的着火点比红磷的着火点低
(5)装置内残留的氧气更少,实验结果更准确
(6)20.2%
(7)铁粉、炭粉、氯化钠和蒸馏水
(8)2Cu+O2+ H2 O+ CO2= Cu2(OH)2CO3,不能;因为空气中二氧化碳含量约只有0.03%,铜不能将装置中的氧气几乎耗尽
【解析】教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1)。该实验中选择使用汞的优点有在汞槽中起到液封作用;生成的化合物加热分解又能得到汞和氧气;能将密闭装置内空气中的氧气集合耗尽,故选BCD;
【实验回顾】由于红磷燃烧将空气中的氧气反应完,集气瓶内剩余气体的成分是:氮气的混合气体;故选D;
【进行猜想】(2)红磷不足(3)实验前没有夹弹簧夹;
【实验与交流】燃烧的条件是可燃物、空气、温度达到可燃物的着火点。故产生上述两 个结果较大差异的主要原因是:白磷着火点比红磷着火点低;
【交流与反思】主要优点是:装置内残留的氧气更少,实验结果更准确
【实验探究2】
烧杯内蒸馏水减少的体积为氧气的体积=90mL﹣63.6mL=26.4mL
空气中氧气含量= ![]() ≈20.2%;
≈20.2%;
所以答案是:BCD;D;红磷不足;实验前没有夹弹簧夹;白磷的着火点比红磷的着火点低;装置内残留的氧气更少,实验结果更准确;20.2%;铁粉、炭粉、氯化钠和蒸馏水;铁粉、炭粉、氯化钠和蒸馏水;2Cu+O2+ H2 O+ CO2= Cu2(OH)2CO3;不能;因为空气中二氧化碳含量约只有0.03%,铜不能将装置中的氧气几乎耗尽;
【考点精析】利用空气的成分及各成分的体积分数对题目进行判断即可得到答案,需要熟知空气是混合物:O2约占1/5,可支持燃烧;N2约占4/5,不支持燃烧,也不能燃烧,难溶于水.