题目内容
65克锌与260克稀硫酸恰好完全反应,发生的化学方程式为Zn+H2SO4═ZnSO4+H2↑,试计算:
(1)生成氢气的质量是多少克?
(2)计算反应后所得溶液中溶质的质量分数?(结果保留一位小数)
(2)计算反应后所得溶液中溶质的质量分数?(结果保留一位小数)
(1)生成氢气的质量是2克
(2)反应后所得溶液中溶质的质量分数为49.8%
锌和稀硫酸反应生成了硫酸锌和氢气,稀硫酸是混合物,不能将其质量带入进行计算,故根据锌的质量可以计算出生成的氢气的质量和硫酸锌的质量,然后结合溶液溶质的质量分数计算公式完成解答即可.
(1)设生成氢气的质量为x,生成硫酸锌的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 161 2
65g x y
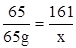
x=161g

y="2" g
(2)反应后所得溶液中溶质的质量分数为: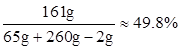
(2)反应后所得溶液中溶质的质量分数为49.8%
锌和稀硫酸反应生成了硫酸锌和氢气,稀硫酸是混合物,不能将其质量带入进行计算,故根据锌的质量可以计算出生成的氢气的质量和硫酸锌的质量,然后结合溶液溶质的质量分数计算公式完成解答即可.
(1)设生成氢气的质量为x,生成硫酸锌的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 161 2
65g x y
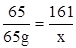
x=161g

y="2" g
(2)反应后所得溶液中溶质的质量分数为:
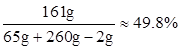

练习册系列答案
相关题目