题目内容
【题目】某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究。
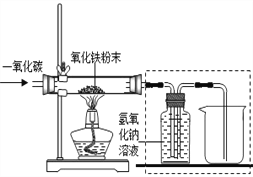
【设计实验】用一氧化碳还原纯净的氧化铁粉末,实验装置如下图。
【进行实验】该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
【分析与讨论】本实验中,玻璃管内固体粉末由红色全部变为黑色。小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料。
【查阅资料】
① CO还原Fe2O3的固体产物的成分与反应温度、反应时间等因素有关
② CO还原Fe2O3的实验过程中固体产物可能有Fe3O4、FeO、Fe
③ NaOH溶液与石灰水相似,能吸收CO2,但不变浑浊
④
物质性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
颜色 | 黑色 | 黑色 | 红色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
【实验与猜想】
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有________ 和 ________
(2)进行猜想:黑色固体粉末可能a.全部为铁粉;b.__________;c._________
【得出结论】
(3)通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称)________。
【反思与评价】
(4)一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度。
(5)实验装置图中采用虚线框内的装置,其作用有________。
A.收集CO B.吸收CO2 C.检验CO2
【实践应用】小明和他的同学想测定某赤铁矿石中Fe2O3的质量分数。用CO与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用足量的NaOH溶液完全吸收,该溶液总质量与反应时间的变化关系如右图。
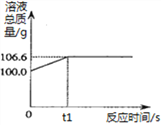
(6)上述反应产生CO2的质量为_______g;
(7)计算该赤铁矿石中氧化铁的质量分数为___________。(需要有计算过程)
【答案】 氧化铁 氧化亚铁(文字、符号均可,前后可颠倒) 全部为四氧化三铁 铁粉与四氧化三铁的混合物(前后可颠倒) 四氧化三铁 A、B 6.6 80%
【解析】(1)由题意可知,黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和氧化亚铁;(2)由题意可知,黑色固体粉末全部能被吸引,黑色固体粉末可能是全部为铁或全部为四氧化三铁或四氧化三铁与铁粉的混合物;【得出结论】(3)由实验的数据可知,氧化铁的质量为:66.0g-60.0g=6g,这些氧化铁中含有的氧元素的质量为: ![]() ,则铁的质量为:6g-1.8g=4.2g,如果6g的氧化铁全部炼成铁,减少的质量应是1.8g,由题意可知,固体减少的质量为:66g-65.8g=0.2g,所以,剩余物中铁氧的质量比为4.2g:1.6g=21:8,该物质是四氧化三铁;【反思与评价】(5)由于一氧化碳有毒能污染空气需要处理尾气,二氧化碳能与氢氧化钠溶液反应。所以,虚线框内的装置,其作用是收集一氧化碳和吸收二氧化碳。(6)反应产生CO2的质量为106.6g-100.0g=6.6g,(7)设该样品中氧化铁的质量为
,则铁的质量为:6g-1.8g=4.2g,如果6g的氧化铁全部炼成铁,减少的质量应是1.8g,由题意可知,固体减少的质量为:66g-65.8g=0.2g,所以,剩余物中铁氧的质量比为4.2g:1.6g=21:8,该物质是四氧化三铁;【反思与评价】(5)由于一氧化碳有毒能污染空气需要处理尾气,二氧化碳能与氢氧化钠溶液反应。所以,虚线框内的装置,其作用是收集一氧化碳和吸收二氧化碳。(6)反应产生CO2的质量为106.6g-100.0g=6.6g,(7)设该样品中氧化铁的质量为![]() ,
,
![]()
![]()
![]()
160 112
![]() 6.6g
6.6g
![]()
![]() =8.0g,赤铁矿石中氧化铁的质量分数=
=8.0g,赤铁矿石中氧化铁的质量分数=![]() 。
。
×100%=80%
答:样品中氧化铁的质量分数为80%。