题目内容
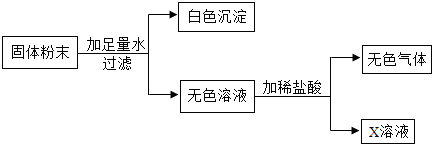
现有一包固体粉末,可能是CaCO3、Na2CO3、Na2SO4、CuSO4、NaCl中的一种或几种,为确定其组成,取适量试样进行下列实验.请根据实验现象判断:(1)取试样溶于水,得到无色澄清溶液,则此固体粉末中一定没有______、______.
(2)取上述溶液适量,滴加过量的BaCl2溶液,出现白色沉淀,再加入过量的稀硝酸,沉淀部分消失并产生气泡.则此固体粉末中一定有______、______.
(3)取步骤(2)实验后的上层清液,加入稀硝酸、硝酸银溶液,出现白色沉淀,由此该同学得出此固体粉末中一定含有NaCl,你认为此结论是否正确______(填“是”或“否”).
(4)对于是否含有NaCl,你认为应对步骤(2)作如何改进______(若步骤(3)填“是”,此空不作答).
【答案】分析:(1)溶于水得到无色澄清溶液,说明原试样中无带颜色的物质、无能生成气体的物质、无不溶于水的物质,排除CaCO3、CuSO4;
(2)滴加过量的BaCl2溶液,出现白色沉淀,白色沉淀可能是碳酸钡或硫酸钡;再根据“加入过量的稀硝酸,沉淀部分消失并产生气泡”沉淀消失产生气泡的是碳酸根,沉淀不能溶解于稀硝酸的是硫酸钡,判断固体中一定有Na2CO3、Na2SO4;
(3)步骤(2)中已经引入了氯离子,故本小题加入稀硝酸、硝酸银溶液出现白色沉淀,只能确定清液中含氯离子,不能判断原溶液中一定含NaCl;
(4)要确定是否含NaCl,在步骤(2)中就不能引入了氯离子,可将BaCl2溶液换成Ba(NO3)2溶液或Ba(OH)2溶液.
解答:解:(1)原溶液中CaCO3不溶于水,CuSO4为蓝色固体,所以原固体粉末中一定不含这两种物质;
(2)根据实验操作及物质的相互反应现象,可知固体中一定有Na2CO3、Na2SO4;
(3)加入稀硝酸、硝酸银溶液出现白色沉淀,只能确定清液中含氯离子,不能判断原溶液中一定含NaCl;
(4)在步骤(2)中就不能引入了氯离子,可将BaCl2溶液换成Ba(NO3)2溶液或Ba(OH)2溶液;
故答案为:(1)CaCO3、CuSO4(2)Na2CO3、Na2SO4(3)否 (4)将BaCl2溶液换成Ba(NO3)2溶液或Ba(OH)2溶液
点评:本题属于实验探究题,较难,解此类试题时要熟记常见物质的特殊反应现象,如鉴别硫酸根离子用钡离子、鉴别氯离子用银离子、碳酸根与酸反应产生气体等.
(2)滴加过量的BaCl2溶液,出现白色沉淀,白色沉淀可能是碳酸钡或硫酸钡;再根据“加入过量的稀硝酸,沉淀部分消失并产生气泡”沉淀消失产生气泡的是碳酸根,沉淀不能溶解于稀硝酸的是硫酸钡,判断固体中一定有Na2CO3、Na2SO4;
(3)步骤(2)中已经引入了氯离子,故本小题加入稀硝酸、硝酸银溶液出现白色沉淀,只能确定清液中含氯离子,不能判断原溶液中一定含NaCl;
(4)要确定是否含NaCl,在步骤(2)中就不能引入了氯离子,可将BaCl2溶液换成Ba(NO3)2溶液或Ba(OH)2溶液.
解答:解:(1)原溶液中CaCO3不溶于水,CuSO4为蓝色固体,所以原固体粉末中一定不含这两种物质;
(2)根据实验操作及物质的相互反应现象,可知固体中一定有Na2CO3、Na2SO4;
(3)加入稀硝酸、硝酸银溶液出现白色沉淀,只能确定清液中含氯离子,不能判断原溶液中一定含NaCl;
(4)在步骤(2)中就不能引入了氯离子,可将BaCl2溶液换成Ba(NO3)2溶液或Ba(OH)2溶液;
故答案为:(1)CaCO3、CuSO4(2)Na2CO3、Na2SO4(3)否 (4)将BaCl2溶液换成Ba(NO3)2溶液或Ba(OH)2溶液
点评:本题属于实验探究题,较难,解此类试题时要熟记常见物质的特殊反应现象,如鉴别硫酸根离子用钡离子、鉴别氯离子用银离子、碳酸根与酸反应产生气体等.

练习册系列答案
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
现有一包干燥的红色粉末,它是由Cu、Fe2O3二种固体中的一种或两种组成,某化学兴趣小组对这包红色粉末的组成进行探究.请你参与并回答有关问题.
查阅资料:Cu在FeCl3溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2
(1)甲同学取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解.甲同学认为红色粉末中只有Fe2O3,而乙同学认为可能只有Fe2O3也可能是Cu、Fe2O3的混合物,你认为______的观点正确(填“甲”或“乙”).
(2)丙同学为进一步确定红色粉末的组成,称取该粉末10.0g装入硬质玻璃管中,按如图在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,记录两组数据如下表:
①由上表的数据可分析出,反应后硬质玻璃管及所盛固体总质量减少的是______的质量.实验中观察到A装置中的现象为______.
②应该选择______组的实验数据计算来确定红色粉末的组成.请你计算反应后固体中铁粉的质量 ( 写出计算过程 )最终计算结果表明:该红色粉末的组成是______
(3)①为了防止溶液倒吸,请判断本实验停止加热前是否需要先断开A和B的连接处并说明理由?______.
②从环保角度,上图装置有严重不足之处.你认为应该如何改进?______.

查阅资料:Cu在FeCl3溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2
(1)甲同学取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解.甲同学认为红色粉末中只有Fe2O3,而乙同学认为可能只有Fe2O3也可能是Cu、Fe2O3的混合物,你认为______的观点正确(填“甲”或“乙”).
(2)丙同学为进一步确定红色粉末的组成,称取该粉末10.0g装入硬质玻璃管中,按如图在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,记录两组数据如下表:
| 反应前 | 反应后 | |
| Ⅰ 组 | 玻璃管和红色粉末的总质量为37g | 玻璃管和固体物质的总质量为34.6g |
| Ⅱ 组 | 洗气瓶B和所盛溶液的总质量为180.0g | 洗气瓶B和瓶中物质的总质量为181.1g |
②应该选择______组的实验数据计算来确定红色粉末的组成.请你计算反应后固体中铁粉的质量 ( 写出计算过程 )最终计算结果表明:该红色粉末的组成是______
(3)①为了防止溶液倒吸,请判断本实验停止加热前是否需要先断开A和B的连接处并说明理由?______.
②从环保角度,上图装置有严重不足之处.你认为应该如何改进?______.

 (2012?青岛模拟)现有一包干燥的红色粉末,它是由Cu、Fe2O3二种固体中的一种或两种组成,某化学兴趣小组对这包红色粉末的组成进行探究.请你参与并回答有关问题.
(2012?青岛模拟)现有一包干燥的红色粉末,它是由Cu、Fe2O3二种固体中的一种或两种组成,某化学兴趣小组对这包红色粉末的组成进行探究.请你参与并回答有关问题.