题目内容
【题目】碳酸钙可用作补钙剂,以工业石灰石(含杂质氧化铁)为原料提纯碳酸钙,某兴趣小组设计方案如下:
方案一:
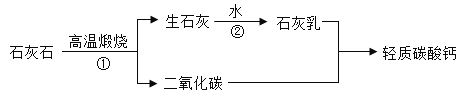
(1)化学反应还伴随着能量的变化,在第①、②步反应中,存在放热现象的是_______;(填序号):
(2)用石灰乳可制取烧碱,写出反应的化学方程式___________。
(3)上述工业生产流程最大的优点是_________。
方案二:
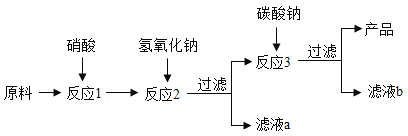
回答下列问题:
(4)为加快反应1中的固体溶解,可采取的措施有_______;(只写一点)。
(5)写出反应2中有沉淀生成的反应化学方程式___________;
(6)若将滤液b中的溶质回收再用,除了得到NaNO3外,还可能得到______(填化学式);
(7)反应1中不选用稀硫酸的原因是__________。
【答案】② Ca(OH)2+Na2CO3=CaCO3↓+2NaOH CO2被充分利用,体现低碳理念,不会产生环境问题 把工业大理石研成粉末、搅拌(任写一个即可) Fe(NO3)3+3NaOH=Fe(OH)3↓+3NaNO3 NaOH、Na2CO3 碳酸钙与稀硫酸反应生成的硫酸钙微溶于水
【解析】
方案一:
(1)反应①是碳酸钙高温煅烧生成氧化钙和二氧化碳,是吸热反应,反应②是氧化钙与水反应生成氢氧化钙,是放热反应;
(2)石灰乳的成分:Ca(OH)2,用石灰乳制取烧碱,让Ca2+生成沉淀,所以选择Na2CO3与之反应,反应方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。
(3)上述工业生产流程最大的优点是 CO2被充分利用,体现低碳理念,不会产生环境问题。
方案二:
(4)加快反应1中的固体溶解,可采取的措施有:把工业大理石研成粉末、搅拌等;
(5)反应2中有沉淀生成的反应化学反应是,硝酸铁和氢氧化钠反应生成氢氧化铁红褐色沉淀和硝酸钠,方程式为:Fe(NO3)3+3NaOH=Fe(OH)3↓+3NaNO3;
(6)将滤液b中的溶质回收再用,除了得到NaNO3外,还可能得到反应2中加入的氢氧化钠,反应3中加入的碳酸钠;
(7)反应1中不选用稀硫酸的原因是:碳酸钙与稀硫酸反应生成的硫酸钙微溶于水。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案