题目内容
实验室制取氢气:
(1)实验原理:通过活泼金属与稀硫酸反应制取氢气通常是用金属
(2)反应方程式:
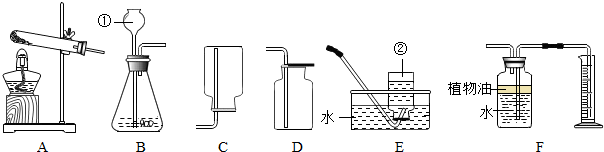
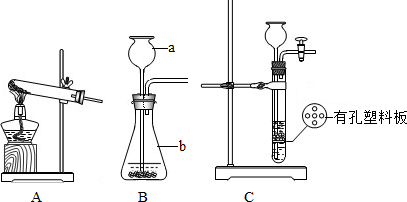
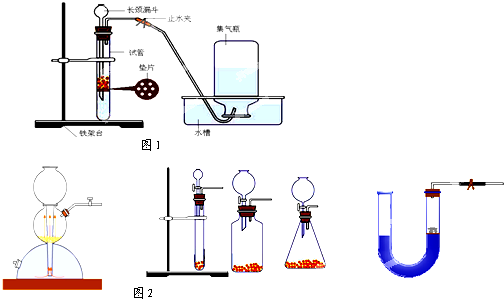
(3)反应装置如图1( 注意点):
A.长颈漏斗的下端需伸入垫片以下,形成液封,以及有利于固液可以分离.
B.由于氢气难溶于水,密度比空气小,故能用
C.优点:可以控制反应的
D.相似的氢气发生装置图2(固液制气,不需加热)
(4)实验步骤
A.按照实验要求,安装好实验仪器;
B.检查仪器装置的气密性:关闭止水夹,向分液漏斗中加入足量的水,若漏斗中的液面能存在一段水柱,并不持续下降,则说明
C.装药品:先将锌粒放在垫片上,打开止水夹后,向长颈漏斗中注入稀盐酸,发生反应放出氢气;
D.验纯气体:因为氢气是可燃性气体,进行性质实验之前务必进行验纯,用排水法收集一试管氢气,用拇指堵住,试管口朝下,移近火焰,再移开拇指点火.如果听到尖锐的爆鸣声,则表示氢气不纯,需要重新收集并验纯;如果只听到很微弱的噗噗的声音,则说明氢气已经纯净.
E.收集气体:利用排水法或向下排空气法收集.
F.结束实验:关闭止水夹,产生的氢气无法从导气管中逸出,试管中的气压增大,就会将稀硫酸由分液漏斗下端管口压回分液漏斗中,从而使稀硫酸与锌粒分离,反应停止.
(1)实验原理:通过活泼金属与稀硫酸反应制取氢气通常是用金属
锌
锌
与稀硫酸或稀盐酸
稀硫酸或稀盐酸
反应,若用镁会反应速度太快,不利于收集
反应速度太快,不利于收集
,若用铁会反应速度太慢
反应速度太慢
,若用浓盐酸与锌反应生成氢气,会使制得的氢气中含有氯化氢
氯化氢
气体,可通过氢氧化钠溶液
氢氧化钠溶液
吸收而除去.
(2)反应方程式:
Zn+H2SO4=ZnSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
(3)反应装置如图1( 注意点):
A.长颈漏斗的下端需伸入垫片以下,形成液封,以及有利于固液可以分离.
B.由于氢气难溶于水,密度比空气小,故能用
排水法
排水法
或向上排空气法
向上排空气法
收集.C.优点:可以控制反应的
发生
发生
,停止
停止
;可以节约药品
节约药品
.D.相似的氢气发生装置图2(固液制气,不需加热)
(4)实验步骤
A.按照实验要求,安装好实验仪器;
B.检查仪器装置的气密性:关闭止水夹,向分液漏斗中加入足量的水,若漏斗中的液面能存在一段水柱,并不持续下降,则说明
原装置气密性良好
原装置气密性良好
;C.装药品:先将锌粒放在垫片上,打开止水夹后,向长颈漏斗中注入稀盐酸,发生反应放出氢气;
D.验纯气体:因为氢气是可燃性气体,进行性质实验之前务必进行验纯,用排水法收集一试管氢气,用拇指堵住,试管口朝下,移近火焰,再移开拇指点火.如果听到尖锐的爆鸣声,则表示氢气不纯,需要重新收集并验纯;如果只听到很微弱的噗噗的声音,则说明氢气已经纯净.
E.收集气体:利用排水法或向下排空气法收集.
F.结束实验:关闭止水夹,产生的氢气无法从导气管中逸出,试管中的气压增大,就会将稀硫酸由分液漏斗下端管口压回分液漏斗中,从而使稀硫酸与锌粒分离,反应停止.
分析:(1)据实验室制取氢气所用药品分析解答,在选择实验室制取气体的药品时,应选择反应速度适中的药品;
(2)据反应原理书写方程式;
(3)据气体的密度和溶解性可确定收集方法,依据装置特点可知其优点;
(4)据检查装置气密性的方法分析解答.
(2)据反应原理书写方程式;
(3)据气体的密度和溶解性可确定收集方法,依据装置特点可知其优点;
(4)据检查装置气密性的方法分析解答.
解答:解:(1)实验室制氢气可用反应速率适中的锌和稀硫酸或稀盐酸,镁与酸反应速度太快,不利于收集,铁与酸反应速度太慢,浓盐酸易挥发出氯化氢气体,使收集的氢气不纯,氯化氢与氢氧化钠溶液反应,氢气不反应,所以可用氢氧化钠溶液除去氯化氢气体;
(2)锌和稀硫酸反应生成硫酸锌和氢气,反应方程式是:Zn+H2SO4═ZnSO4+H2↑;
(3)由于氢气难溶于水,可用排水法收集,密度比空气小,能用向下排空气法收集;
该装置打开夹子,固液接触,生成氢气,关闭夹子,试管内气压变大,将酸压入长颈漏斗,固液分离,反应停止,故可随时控制反应发生和停止,从而可节约药品;
(4)关闭止水夹,向分液漏斗中加入足量的水,若漏斗中的液面能存在一段水柱,并不持续下降,则说明装置气密性良好;
故答案为:(1)锌;稀硫酸或稀盐酸;反应速度太快,不利于收集;反应速度太慢;氯化氢;氢氧化钠溶液;
(2)Zn+H2SO4═ZnSO4+H2↑;
(3)排水法;向上排空气法;发生;停止;节约药品;
(4)原装置气密性良好.
(2)锌和稀硫酸反应生成硫酸锌和氢气,反应方程式是:Zn+H2SO4═ZnSO4+H2↑;
(3)由于氢气难溶于水,可用排水法收集,密度比空气小,能用向下排空气法收集;
该装置打开夹子,固液接触,生成氢气,关闭夹子,试管内气压变大,将酸压入长颈漏斗,固液分离,反应停止,故可随时控制反应发生和停止,从而可节约药品;
(4)关闭止水夹,向分液漏斗中加入足量的水,若漏斗中的液面能存在一段水柱,并不持续下降,则说明装置气密性良好;
故答案为:(1)锌;稀硫酸或稀盐酸;反应速度太快,不利于收集;反应速度太慢;氯化氢;氢氧化钠溶液;
(2)Zn+H2SO4═ZnSO4+H2↑;
(3)排水法;向上排空气法;发生;停止;节约药品;
(4)原装置气密性良好.
点评:本题考查了氢气的制取装置、原理、药品、气密性检查等知识,能较好考查学生分析、解决问题的能力.

练习册系列答案
相关题目