题目内容
(3分)某课外活动小组的同学对一批钢铁样品(含杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行了实验,其中只有一位同学所取的稀硫酸与样品恰好完全反应,实验数据如下:
| | 甲 | 乙 | 丙 |
| 烧杯 + 稀硫酸 | 200g | 150g | 150g |
| 加入的钢铁样品 | 9g | 9g | 14g |
| 充分反应后,烧杯 + 剩余物 | 208.7g | 158.7g | 163.7g |
(1)所取的稀硫酸与钢铁样品恰好完全反应的是__________________同学。
(2)该钢铁样品中含铁的质量分数为多少?
(1)乙 (2)93.3%
解析试题分析:(1)由表中数据分析可知,甲同学和乙同学的实验产生的氢气量相同,且铁样品的质量相同,即都是9g铁样品能产生0.3g氢气,但甲同学用的稀硫酸质量多,说明甲同学的实验中稀硫酸过量;乙同学和丙同学的实验用稀硫酸质量相同,铁样品质量丙同学的多,而产生的氢气量仍相同,即150g稀硫酸能产生0.3g氢气,说明丙同学的实验中铁样品过量,综上分析,乙同学的实验中铁样品和稀硫酸恰好完全反应。
(2)由于乙同学的实验是恰好完全反应的,所以计算时要用乙同学实验的数据,根据铁和稀硫酸反应的化学方程式,利用氢气质量得到铁的质量。
乙同学实验中产生的氢气的质量为150g+9g-158.7g=0.3g;
设反应掉铁的质量为x
Fe+H2SO4=FeSO4+H2↑
56 2
x 0.3g
解得x=8.4g
则铁的质量分数为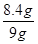 ×100%="93.3%"
×100%="93.3%"
答:该钢铁样品中含铁的质量分数为93.3%。
考点:根据化学反应方程式的计算
点评:此题是关于化学方程式的计算,主要是利用表格及反应方程式来分析和解决化学计算中的有关问题,要求学生有较强的数据分析能力,解题的关键是找出相关的化学反应,以及通过观察、分析和比较表格中的多组数据,找出有用数据,结合方程式中已知量对未知的应求量的质量比进行求解计算,解题要规范。

练习册系列答案
相关题目
某课外活动小组的同学将过量的炭粉和16克氧化铜均匀混合,用下图所示装置进行实验.图中铁架台等装置已略去.请回答有关问题:
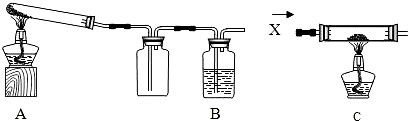
(1)同学们想通过测定消耗碳、氧元素的质量和生成二氧化碳的质量,分析氧化铜和炭粉反应产生的气体除CO2外是否还有其它产物.反应一段时间后停止加热,冷却到室温.反应前、后测得的数据如下:
分析数据发现,反应中消耗碳和氧元素的质量 (填“大于”、“小于”或“等于”)生成二氧化碳的质量.下列4项中跟这一结果有关的有哪几项? .(填写字母)
A.装置中还有一部分CO2未被石灰水溶液吸收
B.氧化铜和炭粉反应产生的气体除CO2外还有CO
C.氧化铜和炭粉没有完全反应
D.该反应不符合质量守恒定律
(2)有同学认为用图示装置C代替上面的装置A,加热前先通一会气体X,停止加热后再通一会该气体,这样可使实验测得的数据更能准确的说明问题.你认为在O2、N2和H2三种气体中,X应选择哪一种气体? .
(3)实验中最多能得到铜多少克?(写出计算过程)

(1)同学们想通过测定消耗碳、氧元素的质量和生成二氧化碳的质量,分析氧化铜和炭粉反应产生的气体除CO2外是否还有其它产物.反应一段时间后停止加热,冷却到室温.反应前、后测得的数据如下:
| 装置 | 反应前 | 反应后 |
| A | 试管的质量38.2 克 氧化铜和炭粉混合物的质量20.0克 |
试管和固体物质的质量56.8 克 |
| B | 反应后瓶内石灰水比反应前增重1.1 克 | |
A.装置中还有一部分CO2未被石灰水溶液吸收
B.氧化铜和炭粉反应产生的气体除CO2外还有CO
C.氧化铜和炭粉没有完全反应
D.该反应不符合质量守恒定律
(2)有同学认为用图示装置C代替上面的装置A,加热前先通一会气体X,停止加热后再通一会该气体,这样可使实验测得的数据更能准确的说明问题.你认为在O2、N2和H2三种气体中,X应选择哪一种气体?
(3)实验中最多能得到铜多少克?(写出计算过程)

 (2012?海珠区一模)某课外活动小组的同学为测定一瓶BaCl2溶液溶质的质量分数,做了以下实验,请回答有关问题:
(2012?海珠区一模)某课外活动小组的同学为测定一瓶BaCl2溶液溶质的质量分数,做了以下实验,请回答有关问题: